
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
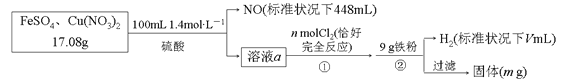
下列叙述中不正确的是
A.n=0.02 B.V=2240
C.m=3.2 D.原混合物中FeSO4的质量分数约为89%
【答案】C
【解析】步骤②中加入铁粉后有H2生成,说明前面所加硫酸过量,溶液a能与Cl2反应,说明含有Fe2+,即加稀硫酸反应后,Fe2+有剩余;则加入稀硫酸时发生的反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中NO3全部被还原为NO,根据元素守恒由n(NO)=0.02 mol可得样品中m[Cu(NO3)2]=0.01 mol×188 g·mol1=1.88 g,则m(FeSO4)=17.08 g1.88 g=15.20 g,其物质的量n(FeSO4)=0.1 mol,原混合物中FeSO4的质量分数为![]() ,故D正确。反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中消耗的Fe2+为0.06 mol,则溶液a中的Fe2+为0.04 mol,根据反应2Fe2++Cl2==2Fe3++2Cl可知,氧化0.04 mol Fe2+需要0.02 mol Cl2,即n=0.02,故A正确。反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中消耗的H+为0.08 mol,则溶液a中的H+为0.14 mol×20.08 mol=0.2 mol,根据铁元素守恒可知溶液a通入Cl2后含有0.1 mol Fe3+,溶液a中还有0.01 mol Cu2+;反应2Fe3++Fe==3Fe2+消耗0.05 mol Fe,反应Cu2++Fe==Cu+Fe2+消耗0.01 mol Fe,同时生成0.01 mol Cu,反应Fe+2H+==Fe2++H2↑消耗0.1 mol Fe,生成0.1 mol H2,标准状况下H2体积为2240 mL,故B正确。通过以上分析可知,生成的Cu的质量为0.64 g,剩余Fe的质量为9 g(0.05+0.01+0.1) mol×56 g·mol1=0.04 g,则最后过滤所得固体质量m=(0.64+0.04) g=0.68 g,故C不正确。
,故D正确。反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中消耗的Fe2+为0.06 mol,则溶液a中的Fe2+为0.04 mol,根据反应2Fe2++Cl2==2Fe3++2Cl可知,氧化0.04 mol Fe2+需要0.02 mol Cl2,即n=0.02,故A正确。反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中消耗的H+为0.08 mol,则溶液a中的H+为0.14 mol×20.08 mol=0.2 mol,根据铁元素守恒可知溶液a通入Cl2后含有0.1 mol Fe3+,溶液a中还有0.01 mol Cu2+;反应2Fe3++Fe==3Fe2+消耗0.05 mol Fe,反应Cu2++Fe==Cu+Fe2+消耗0.01 mol Fe,同时生成0.01 mol Cu,反应Fe+2H+==Fe2++H2↑消耗0.1 mol Fe,生成0.1 mol H2,标准状况下H2体积为2240 mL,故B正确。通过以上分析可知,生成的Cu的质量为0.64 g,剩余Fe的质量为9 g(0.05+0.01+0.1) mol×56 g·mol1=0.04 g,则最后过滤所得固体质量m=(0.64+0.04) g=0.68 g,故C不正确。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】《天工开物》膏液篇,关于提取油脂有如下的叙述,“若水煮法,则并用两釜。将蓖麻、苏麻子碾碎,入一釜中,注水滚煎,其上浮沫即油”。此文中涉及到的下列操作是
A. 分液 B. 蒸发 C. 升华 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)重铬酸钠在制革工业、印刷工业、电镀工业等有重要用途,铬铁矿的主要成分可表示为FeOCr2O3,还含有Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钠(Na2Cr2O7)的流程图:

(1)煅烧前应将铬铁矿充分粉碎,其目的是_________。灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,以下各实验仪器中不需要的是_____。
a.陶瓷坩埚 b.铁坩埚 c.三脚架 d.泥三角
(2)转窑中发生的主要反应为:
①Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
②__FeOCr2O3+__Na2CO3+__O2![]() __Na2CrO4+__Fe2O3+__ 。
__Na2CrO4+__Fe2O3+__ 。
请配平反应②的化学方程式。
(3)生成固体Y的离子方程式为_______________。
(4)向母液中加入浓硫酸,把铬酸钠转化为重铬酸钠,经两次蒸发,主要是除去___(填化学式),冷却至30~40℃得到产品晶体。洗涤该晶体的溶剂最好是__________(填序号)。
a.蒸馏水 b.无水乙醇 c.75%乙醇溶液
(5)为了测定实验制得的产品中Na2Cr2O7的含量,称取样品0.140g置于锥形瓶中,加50mL水;再加入2gKI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min;然后加150mL蒸馏水并加入3mL 0.5%淀粉溶液;用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL。(假定杂质不参加反应,已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-)
①终点实验现象是________。
②该产品中Na2Cr2O7的纯度为____ 。(以质量分数表示)
③若滴定管在滴定前俯视读数,滴定结束后仰视读数,测得样品的纯度将 (填“偏高”、或“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态可逆反应:mA(g)+nB(g)![]() pC(g)+qD(g),有如图关系,试用“>”或“<”填(1)~(3)题。
pC(g)+qD(g),有如图关系,试用“>”或“<”填(1)~(3)题。

(1)温度T1 _________T2 。
(2)压强p1 _________p2 。
(3)m+n_________p+q。
(4)正反应为_____反应(填“放热”或“吸热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:

(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是_______(用化学式表示,下同);碱性最强的是_______。
(2)④、⑤、⑥的简单离子半径由大到小的顺序是_______(用离子符号表示)
(3)有两种离子化合物,均由①、④、⑤、⑧四种元素组成.这两种物质可在水溶液中发生反应。写山该反应的离子方程式:_______________。
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族)__________________;_____________。
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:

若A、B、C含同一金属元素,X为强电解质.且反应都在溶液中进行,则B的化学式为_____,X的化学式可能为______或______(写不同类别物质)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是

A.治疗疟疾的青蒿素(如图),分子式为C15H20O5
B.甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种
C.对三联苯![]() 分子中至少有16个原子共平面
分子中至少有16个原子共平面
D.油脂和乙烯在一定条件下都能与水反应,且反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某气态有机物与过量氧气混合完全燃烧,恢复到室温,使燃烧产物通过浓硫酸,体积比反应前减少40mL,再通过NaOH溶液,体积又减少了40mL,该有机物的分子式是
A. CH4 B. C2H6 C. CH2O D. C2H4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如下图。下列叙述中正确的是

A. 反应的化学方程式为5YX
B. t1时,Y的浓度是X浓度的1.5倍
C. t2时,正、逆反应速率相等
D. t3时,逆反应速率大于正反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com