
【题目】(15分)重铬酸钠在制革工业、印刷工业、电镀工业等有重要用途,铬铁矿的主要成分可表示为FeOCr2O3,还含有Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钠(Na2Cr2O7)的流程图:

(1)煅烧前应将铬铁矿充分粉碎,其目的是_________。灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,以下各实验仪器中不需要的是_____。
a.陶瓷坩埚 b.铁坩埚 c.三脚架 d.泥三角
(2)转窑中发生的主要反应为:
①Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
②__FeOCr2O3+__Na2CO3+__O2![]() __Na2CrO4+__Fe2O3+__ 。
__Na2CrO4+__Fe2O3+__ 。
请配平反应②的化学方程式。
(3)生成固体Y的离子方程式为_______________。
(4)向母液中加入浓硫酸,把铬酸钠转化为重铬酸钠,经两次蒸发,主要是除去___(填化学式),冷却至30~40℃得到产品晶体。洗涤该晶体的溶剂最好是__________(填序号)。
a.蒸馏水 b.无水乙醇 c.75%乙醇溶液
(5)为了测定实验制得的产品中Na2Cr2O7的含量,称取样品0.140g置于锥形瓶中,加50mL水;再加入2gKI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min;然后加150mL蒸馏水并加入3mL 0.5%淀粉溶液;用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL。(假定杂质不参加反应,已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-)
①终点实验现象是________。
②该产品中Na2Cr2O7的纯度为____ 。(以质量分数表示)
③若滴定管在滴定前俯视读数,滴定结束后仰视读数,测得样品的纯度将 (填“偏高”、或“偏低”或“无影响”)。
【答案】
(1)增大表面积,提高反应速率,使反应更充分(2分) a(1分)
(2)4、8、7、8、2、8CO2(2分)
(3)AlO2-+2H2O+CO2=HCO3-+Al(OH)3↓或2AlO2-+3H2O+CO2=CO32-+2Al(OH)3↓(2分)
(4)Na2SO4(1分);c(2分)
(5)①当滴入最后一滴标准液,溶液由蓝色变为无色,且半分钟内不复原(2分)
②93.6%(2分)
③偏高(1分)
【解析】
试题分析:
(1)增大接触面积会加快反应速率,煅烧前将铭铁矿粉碎的作用是增大接触面积加快反应速率,反应更充分;灼烧固体的容器为坩埚,陶瓷坩埚中含有SiO2,与碳酸钠发生化学反应,所以应选用铁坩埚,坩埚应固定在三脚架和泥三角上,答案选a。
(2)反应中Fe元素化合价从+2价升高到+3价,Cr元素化合价从+3价升高到+6价,即1molFeOCr2O3失去7个电子,氧气是氧化剂,1mol氧气得到4mol电子,根据原子守恒和电子得失守恒可知反应的方程式为4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2。
8Na2CrO4+2Fe2O3+8CO2。
(3)根据(2)中分析可知X是氧化铁,M是CO2,则Y是氢氧化铝,生成固体Y的离子方程式为AlO2-+2H2O+CO2=HCO3-+Al(OH)3↓或2AlO2-+3H2O+CO2=CO32-+2Al(OH)3↓。
(4)向母液中加入浓硫酸,把铬酸钠转化为重铬酸钠,同时还有硫酸钠生成,因此经两次蒸发,主要是除去Na2SO4;为减少洗涤时晶体的损失,洗涤该晶体的溶剂最好是75%乙醇溶液,答案选c。
(5)①碘遇淀粉显蓝色,因此终点实验现象是当滴入最后一滴标准液,溶液由蓝色变为无色,且半分钟内不复原。
②根据Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-得关系式
Cr2O72-~~6S2O32-
1 6
x 0.1000mol/L×0.03L
1:6=x:(0.1000mol/L×0.03L)
解得x=0.0005mol
则m(Na2Cr2O7)=0.0005mol×262g/mol=0.131g
其质量分数=0.131g/0.140g×100%≈93.6%
③若滴定管在滴定前俯视读数,读数偏小,滴定结束后仰视读数,读数偏大,因此测得样品的纯度将偏高。


科目:高中化学 来源: 题型:
【题目】某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mlCl2,恰好全部转化成Fe3+。x值为:
A.0.80B.0.85C.0.90D.0.93
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是大气污染物,造成酸雨的主要原因,用如图所示装置可以既吸收工厂排放的废气中的SO2,又可以生成一定量的硫酸,下列说法正确的是

A. a为正极,b为负极
B. 生产过程中氢离子由右移向左
C. 从左下口流出的硫酸的质量分数一定大于50%
D. 负极反应式为SO2+2H2O-2e-=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有用饱和Na2SO4溶液浸泡过的琼脂。下列说法正确的是

A.b电极上发生的反应:Fe2+ - e- ═ Fe3+
B.a电极上发生氧化反应:MnO4- + 8H+ + 5e- ═ Mn2+ + 4H2O
C.外电路电子的流向是从a到b
D.电池工作时,盐桥中的SO42-移向甲烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C4H8O2的有机物能与金属钠反应放出氢气,且与新制氢氧化铜反应生成砖红色沉淀,符合条件的有机物有(不含立体异构)
A. 4种 B. 5种 C. 6种 D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将三种黑色粉末组成的混和物加入到足量的某热浓酸中,充分反应后得到蓝绿色溶液和两种气体。将从蓝绿色溶液中分离得到的盐与0.15mol还原铁粉恰好反应完全,可得浅绿色溶液和6.4g红色沉淀;将上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,据此推断黑色粉末可能为
A.物质的量 FeS:CuO:Fe =1:1:1 B.物质的量 C:CuO:Fe=3:2:2
C.质量 MnO2:CuO:C=5.5:8:12 D.质量 Fe:C:CuO=7:5:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】装置(Ⅰ)为铁镍(Fe-Ni)可充电电池:Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是
Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是

A. 闭合K时,X的电极反应式为:2H++2e-= H2↑
B. 闭合K时,A电极反应式为:NiO2+2e-+2H+= Ni(OH)2
C. 给装置(Ⅰ)充电时,B极参与反应的物质被氧化
D. 给装置(Ⅰ)充电时,OH- 通过阴离子交换膜,移向A电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
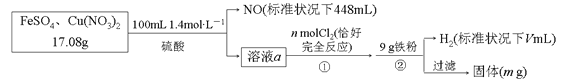
下列叙述中不正确的是
A.n=0.02 B.V=2240
C.m=3.2 D.原混合物中FeSO4的质量分数约为89%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如右图。下列说法中不正确的是( )

A. Y代表盐酸与镁条的反应
B. a点时反应Y消耗镁条的量少
C. b点表示此时两溶液pH相等
D. c点表示此时反应结束
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com