
��Ļ������������Ϳ����з�������Ҫ���á�
��1��SO2Cl2����������ҽҩƷ��Ⱦ�ϡ�������Լ��ȡ���֪��SO2Cl2(g) SO2(g)��Cl2(g) ��H����97.3 kJ��mol��1��ij�¶�ʱ�����Ϊ1 L�ĺ����ܱ������г���0. 20mol SO2Cl2���ﵽƽ��ʱ�������к�0.18mol SO2����˹��̷�Ӧ���յ�����Ϊ_____kJ�����¶�ʱ��Ӧ��ƽ�ⳣ��Ϊ_____�����������û��������������BaCl2��Һ�У��������ɳ���������Ϊ_______��
SO2(g)��Cl2(g) ��H����97.3 kJ��mol��1��ij�¶�ʱ�����Ϊ1 L�ĺ����ܱ������г���0. 20mol SO2Cl2���ﵽƽ��ʱ�������к�0.18mol SO2����˹��̷�Ӧ���յ�����Ϊ_____kJ�����¶�ʱ��Ӧ��ƽ�ⳣ��Ϊ_____�����������û��������������BaCl2��Һ�У��������ɳ���������Ϊ_______��
��2����ҵ���Ʊ�����Ĺ����д��ڷ�Ӧ��2SO2(g)��O2(g) 2SO3(g) ��H����198kJ��mol��1400�棬1.01��105Pa�����ݻ�Ϊ2L�ĺ����ܱ������г���һ���� SO2��O2��n(SO3)��n(O2)��ʱ��ı仯������ͼ��ʾ��
2SO3(g) ��H����198kJ��mol��1400�棬1.01��105Pa�����ݻ�Ϊ2L�ĺ����ܱ������г���һ���� SO2��O2��n(SO3)��n(O2)��ʱ��ı仯������ͼ��ʾ��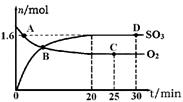
��0��20min��Ӧ��ƽ�����ʦ�(O2)��___________��
������������ȷ���� ��
a��A�����(SO2)������(SO2)
b��B�㴦��ƽ��״̬
c��C���D��n(SO2)��ͬ
d�������������䣬500��ʱ��Ӧ��ƽ�⣬n(SO3)��ͼ��D���ֵ��
��3����ҵ����Na2SO3��Һ���������е�SO2��������ͨ��1.0 mol��L��1��Na2SO3��Һ������ҺpHԼΪ6ʱ��Na2SO3��Һ����SO2�����������½���Ӧ�������ռ�����ʱ��Һ��c (SO32��)��Ũ����0.2 mol��L��1������Һ��c(HSO3��)��_________mol��L��1��
��17�֣���1��17.5��3�֣� 1.62��3�֣� 46.6g��3�֣�
��2��0.02mol(L��min) ��3�֣� ac��2�֣� ��3��1.6mol/L��3�֣�
���������������1���ﵽƽ��ʱ�������к�0.18mol SO2��������Ȼ�ѧ����ʽ��֪���˹��̷�Ӧ���յ�����Ϊ97.3 kJ��mol��1��0.18mol��17.5kJ�����ݷ���ʽ��֪
SO2Cl2(g) SO2(g)��Cl2(g)
SO2(g)��Cl2(g)
��ʼŨ�ȣ�mol/L�� 0.20 0 0
ת��Ũ�ȣ�mol/L�� 0.18 0.18 0.18
ƽ��Ũ�ȣ�mol/L�� 0.02 0.18 0.18
���Ը��¶��·�Ӧ��ƽ�ⳣ��K��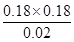 ��1.62��
��1.62��
���û��������������BaCl2��Һ�У�������ӦSO2��Cl2��2H2O��H2SO4��2HCl�����Դ�ʹƽ�����������Ӧ������У�����������ɳ��������ʵ�����0.20mol�������ᱵ������Ϊ0.20mol��232g/mol��46.6g��
��2���ٸ���ͼ���֪20minʱ������������ʵ�����1.6mol�����������������ʵ�����0.8mol��Ũ����0.4mol/L������0��20min��Ӧ��ƽ�����ʦ�(O2)��0.4mol/L��20min��0.02mol(L��min)��
��a������ͼ���֪A�㷴Ӧû�дﵽƽ��״̬��ƽ��������Ӧ������У������(SO2)������(SO2)��a��ȷ��b��B�����ʵ�Ũ����Ȼ�DZ仯�ģ���Ӧû�д���ƽ��״̬��b����ȷ��c��C���D�������ͬ�����µ�ƽ��״̬�����n(SO2)��ͬ��c��ȷ��d������Ӧ�Ƿ��ȷ�Ӧ�������������䣬�����¶�ƽ�����淴Ӧ�����ƶ�������500��ʱ��Ӧ��ƽ�⣬n(SO3)��ͼ��D���ֵС��d����ȷ����ѡac��
��3����Һ��c (SO32��)��Ũ����0.2 mol��L��1��������c (SO32��)��Ũ�ȣ�1.0mol/L��0.2mol/L��0.8mol/L����˸��ݷ���ʽSO32����SO2��H2O��2HSO3����֪��Һc(HSO3��)��0.8mol/L��2��1.6mol/L��
���㣺���鷴Ӧ�ȡ���Ӧ���ʡ�ƽ�ⳣ�����йؼ��㣻���������ƽ��״̬��Ӱ���Լ���Һ������Ũ�Ⱥͳ������ɵ��йؼ���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���Ŵ�����Ⱦ���������أ������ܼ��š�������ȫ�����������ŷţ��о�NOx��SO2��CO�ȴ�����Ⱦ����Ĵ�����������Ҫ���塣
��1����ͼ����101 kPa��298K������1mol NO2��1mol CO��Ӧ����1mol CO2��1mol NO�����е������仯ʾ��ͼ��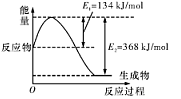
��֪��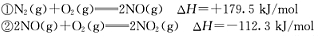
��д��NO��CO��Ӧ��������Ⱦ������Ȼ�ѧ��
��ʽ�� ��
��2����0.20 mol N02��0.10 mol CO����һ���ݻ��㶨Ϊ1L���ܱ������з�����Ӧ���ڲ�ͬ�����£���Ӧ�����в������ʵ�Ũ�ȱ仯״����ͼ��ʾ��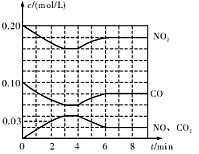
������˵����ȷ���� ������ţ���
a�������ڵ�ѹǿ�������仯˵���÷�Ӧ�ﵽ����
b�������������ٳ���0�� 20 mol NOʱ��ƽ��������Ӧ�����ƶ���K����
c�������¶Ⱥ�K��С��N02��ת���ʼ�С
d����������ڳ���He������Ӧ��������С��Ũ���������Է�Ӧ��������
�ڼ������NO��0��2 min��ƽ����Ӧ����v��NO��= mol��L-1��min-1
�۵�4 minʱ�ı�ķ�Ӧ����Ϊ ������¡����������¡�������
�ܼ��㷴Ӧ�ڵ�6 minʱ��ƽ�ⳣ��K= ���������¶Ȳ��䣬��ʱ���������г���CO��NO��0��060 mol��ƽ�⽫ �ƶ��������������������
��3����ѧ��������ͼ��ʾװ����ԭ���ԭ����SO2ת��Ϊ��Ҫ�Ļ���ԭ�ϡ��为����ӦʽΪ ������0.25 mol SO2�����գ���ͨ�����ӣ�H+������Ĥ��H+�����ʵ���Ϊ mol��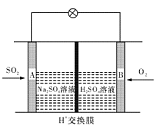
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ�ϳ������÷�Ӧ���������������飬���ǰ��渱��Ӧ�ڡ�
��C2H4(g)+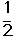 O2(g) ��
O2(g) ��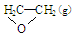 ; ��H1 ��C2H4(g)+3O2(g) �� 2CO2(g)+2H2O(g); ��H2
; ��H1 ��C2H4(g)+3O2(g) �� 2CO2(g)+2H2O(g); ��H2
��1��д������������ȼ�յ��Ȼ�ѧ��Ӧ����ʽ����____________________________��
��2����ҵ�����У���ͨ��ijһ��ʩ���ӿ췴Ӧ�ٶ��Է�Ӧ��Ӱ���С���Ӷ���������������Ч�ʡ���ҵ������ȡ�����ִ�ʩ��_______________��
A�����߷�Ӧ��ϵ���¶�B��������ϵ��������Ũ��
C��ʹ�ú��ʵĴ���D�����ͷ�Ӧ��ϵ��ѹǿ
��3����֪C=C��O=O��C��C���ֱܷ�Ϊa kJ��mol-1��b kJ��mol-1��c kJ��mol-1������������C��O����Ϊ kJ��mol-1��
��4����Ӧ�ڿ�����Ƴ�ȼ�ϵ�أ����������������Һ��������Ӧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
(1)��ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ��CO(g)��2H2(g) CH3OH(g)����H1
CH3OH(g)����H1
��Ӧ��CO2(g)��3H2(g) CH3OH(g)��H2O(g)����H2
CH3OH(g)��H2O(g)����H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ�����________(���)��
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)��
| �¶� | 250 �� | 300 �� | 350 �� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����ܡ�������δ�������������Դ֮һ��
��1��ʵ���ã�1 g����ȼ������Һ̬ˮʱ�ų�142.9 kJ���������ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ__________________________��
��2�����ú��ܰ�ˮ�ֽ�����������Ŀǰ���о��Ŀ��⡣��ͼ�����е�һ�����̣����������˹����ĵ⣨��ʾ����Ӧ�ڵIJ�����O2��SO2��H2O����
������з�Ӧ�Ļ�ѧ����ʽ����Ӧ��________________����Ӧ��________________���˷���ȡ����������ŵ���____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����塣
��1����CO2�뽹̿��������CO��CO�����������ȡ�
����֪��Fe2O3(s) + 3C(ʯī) =" 2Fe(s)" + 3CO(g) ��H 1 =" +489.0" kJ��mol��1
C(ʯī) +CO2(g) = 2CO(g) ��H 2 =" +173.0" kJ��mol��1
��CO��ԭFe2O3(s)���Ȼ�ѧ����ʽΪ ��
��ij��C��H��O����Ԫ�ص��л���A�����ⶨ̼����������Ϊ52.16%�������������13.14%����������ȼ�ϵ�أ���KOH��ҺΪ���Һ����ԭ�ϣ�д���õ�صĸ�����Ӧʽ ��
��2��ijʵ�齫CO2��H2����һ��������ܱ������У�������Ӧ��
CO2(g) +3H2(g)  CH3OH(g) +H2O(g) ��H =��49.0 kJ��mol��1
CH3OH(g) +H2O(g) ��H =��49.0 kJ��mol��1
�ش����⣺
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ ��
�ڰ�0.5mol��CO2��1.5mol��H2����2L���ܱ������У�����Ӻ���c��H2��=0.15mol/L,��CH3OH��ʾ�÷�Ӧ�����ʣ�v(CH3OH)=
����ͼ���ڷ�Ӧ��ϵ�м����������Ӧ��������,E2�ı仯�� ������� ����С�����䡱��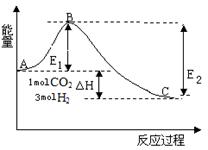
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ijʵ��С����ȼ�շ������ⶨij�л�����̼�����Ԫ�صĺ���������ֶ������������̽�������ѳ�������Ʒ�����������У�������ͭ���������ڸ�����������Ʒȫ��������Ϊˮ�Ͷ�����̼��Ȼ��ֱ�ⶨ���ɵ�ˮ�Ͷ�����̼��ʵ������õ���װ������ͼ��ʾ������A��Dװ�ÿ����ظ�ʹ�á�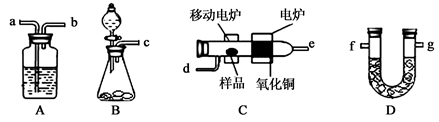
��ش��������⣺
��1���밴������������ʵ��װ��B�� ��C��A��D�� ����װ�ñ����д����
��2��Bװ������O2ʱ���õ�ҩƷ�� ��ʵ���У���ʼ��Cװ�ü���֮ǰ��Ҫͨһ��ʱ���������Ŀ���� ��ֹͣ���Ⱥ�ҲҪ��ͨһ��ʱ���������Ŀ���� .��
��3����֪ȡ2.3g����ƷX��������ʵ�飬���ⶨAװ������2.7g��Dװ������4.4g���������X���ʵ�ʵ��ʽ ��
��4����С��ͬѧ��һ��ʵ���ã�2.3g�� X����������Ʒ�Ӧ�ɷų�560mLH2���ѻ���ɱ�״���£�������֪X����ֻ��һ�������š��������Ϻ�ѧ�����ֽ���������̽��ʵ�飺ʵ��һ��X��һ�������¿ɴ��������������л���Y��ʵ�����X��Y��Ũ������������������л���Z����д��ʵ����з�Ӧ�Ļ�ѧ����ʽ ��
�� ��ȥZ�л��е�Y������Լ�����Ҫ������ �� ��
��5������֪������2.3gҺ̬X����������ȫȼ�����ɶ�����̼�����Һ̬ˮʱ�ɷų�68.35kJ��������д��X��������ȼ�յ��Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ݡ��������������������궬�죬һ�����ִ���������Ⱦ���������������п��ܽ����������ء�����ҵ��λ����ʵ�����ʵ��Ա���ݼٻ��Թ����ơ��������е�CO���������SO2���̳�����Ⱦ�ǵ�������������ԭ��֮һ����ѧ��Ӧԭ���Ǽ��ٺͿ��������������������ݡ�
��1��CO2�������������������գ�����0.4molCO2������200ml 3mol/LNaOH��Һ������ȫ���գ���Һ������Ũ���ɴ�С��˳��Ϊ��
��2�� CO������ȼ�ϵ�أ���KOH��Һ������ʣ��������ֱ����CO�Ϳ��������������У���������Ӧ����ʽΪ��___________________��
��3�� ����Fe2+��Fe3+�Ĵ����ã������½�SO2ת��ΪSO42�����Ӷ�ʵ�ֶ�SO2�Ĵ���(�ܷ�ӦΪ2SO2+O2+2H2O��2H2SO4)����֪����SO2�ķ���ͨ�뺬Fe2+��Fe3+����Һʱ������һ����Ӧ�����ӷ���ʽΪ4Fe2+ + O2+ 4H+ ��4Fe3+ + 2H2O������һ��Ӧ�����ӷ���ʽΪ ��
��4��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10��9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10��4mo1/L �������ɳ�������CaCl2��Һ����СŨ��Ϊ ��
��5����֪�ڳ��³�ѹ�£�
��CH3OH(l)+O2(g)= CO(g)+2H2O(g) ��H=" -359.8" kJ��mol��1
�� 2CO(g)��O2(g)=2CO2(g) ?��H=" -556.0" kJ��mol��1
�� H2O(g)=H2O(l)?��H=" -44.0" kJ��mol��1
д�����ּ״�ȼ���ȵ��Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����̼ѭ��������������ҵĸ߶����ӣ�����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2����Ϊ��ѧ���о�����Ҫ���⡣
��1������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�Ӧ
CO(g)��H2O(g) CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1��6 | 2��4 | 6 |
| 2 | 900 | 2 | 1 | 0��4 | 1��6 | 3 |
| 3 | 900 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com