
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)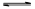 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
(1)①1/ 6或0.17 ②<1 (填0<a/b<1亦可) ③<
(2)CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol
(3)c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-) > c(OH-) (4)5.6×10—5
(5)CH3OCH3-12e—+3H2O=3CO2+12H+
解析试题分析:(1)①、平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数k=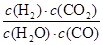 =
=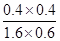 =0.17。
=0.17。
②由于CO与H2的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2的转化率,则增大H2的物质的量,即a/b 的值小于1,
③由①900℃时,该反应的平衡常数为0.17,实验4,在900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时浓度商Qc=1,大于平衡常数0.17,故反应向逆反应进行,所以V正<V逆,
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ·mol-1
③H2O(g)=H2O(l)△H=-44.0kJ·mol-1
依据盖斯定律①-②+③×4得:2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l)△H=-885.6KJ·mol-1;
即CH3OH(l)+O2(g)="CO" (g)+2H2O(l)△H=-442.8KJ·mol-1;
(3)向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液,二者恰好反应,所得溶液为NaHC2O4溶液,在该溶液中,直接电离出的Na+和HC2O4-浓度最大,NaHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解,所以c(Na+)>c(HC2O4-),c(H+)> c(OH-)。,溶液中水电离生成氢离子,故c(H+)>c(C2O42-),溶液呈酸,电离产生的c(C2O42-)原大于 c(OH-)。,溶液中离子浓度c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-) > c(OH-)。
(4)Na2CO3溶液的浓度为1×10-4mol·L-1,等体积混合后溶液中c(CO32-)= ×2×10-4mol·L-1=1×10-4mol·L-1,根据Ksp=c(CO32-)·c(Ca2+)=2.8×10-9可知,钙离子最小浓度c(Ca2+)=
×2×10-4mol·L-1=1×10-4mol·L-1,根据Ksp=c(CO32-)·c(Ca2+)=2.8×10-9可知,钙离子最小浓度c(Ca2+)= mol·L-1=2.8×10-5mol·L-1,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol·L-1=5.6×10—5mol·L-1。
mol·L-1=2.8×10-5mol·L-1,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol·L-1=5.6×10—5mol·L-1。
(5)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.二甲醚放电生成二氧化碳与氢离子,电极反应式为 CH3OCH3-12e-+3H2O=2CO2+12H+。
考点:考查化学平衡、反应热、以及难溶电解质的溶解平衡等问题。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
硫的化合物在生产和科研中发挥着重要作用。
(1)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:SO2Cl2(g) SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
(2)工业上制备硫酸的过程中存在反应:2SO2(g)+O2(g) 2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
2SO3(g) △H=-198kJ·mol-1400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。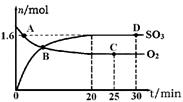
①0~20min反应的平均速率υ(O2)=___________。
②下列叙述正确的是 。
a.A点υ正(SO2)>υ逆(SO2)
b.B点处于平衡状态
c.C点和D点n(SO2)相同
d.其它条件不变,500℃时反应达平衡,n(SO3)比图中D点的值大
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,应更换吸收剂。此时溶液中c (SO32-)的浓度是0.2 mol·L-1,则溶液中c(HSO3-)是_________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
请回答下列问题:
(1)该反应的热化学方程式为_______________________________________________。
(2)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与双氧水反应生成液态水时放出的热量是________ kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
苯乙烯是现代石油化工产品中最重要的单体之一。在工业上,苯乙烯可由乙苯和CO2
催化脱氢制得。总反应原理如下: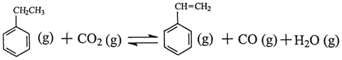 △H
△H
回答下列问题:
(1)乙苯在CO2气氛中的反应可分两步进行: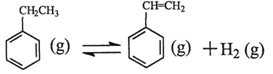 △H1=+117.6kJ·mol-1
△H1=+117.6kJ·mol-1
H2 (g)+CO2 (g) CO (g)+H2O (g) △H2=+41.2kJ·mol-1
CO (g)+H2O (g) △H2=+41.2kJ·mol-1
由乙苯制取苯乙烯反应的 。
。
(2)在温度为T1时,该反应的平衡常数K=0.5mol/L。在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得混合物中各组分的物质的量均为1.0mol。
①该时刻化学反应 (填“是”或“不是”)处于平衡状态;
②下列叙述能说明乙苯与CO2在该条件下反应已达到平衡状态的是 (填正确答案编号);
a.正、逆反应速率的比值恒定 b.c(CO2)=c(CO)
c.混合气体的密度不变 d.CO2的体积分数保持不变
③若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度 (填正确答案编号)
| A.大于0.5mol/L | B.小于0.5mol/L |
| C.等于0.5mol/L | D.不确定 |
 ,则反应达到平衡时苯乙烯的浓度为 , (均用含
,则反应达到平衡时苯乙烯的浓度为 , (均用含 、P的表达式表示)。
、P的表达式表示)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是________。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g) CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。 CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为__________________________________。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为__________________________________。 CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | | |
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
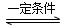 2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。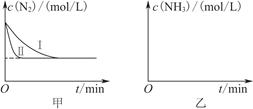
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题: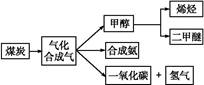
Ⅰ.已知该产业链中某反应的平衡常数表达式为:K=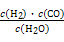 ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:
。
Ⅱ.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0 MPa,温度230~280 ℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
ΔH1="-90.7" kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
ΔH2="-23.5" kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH3="-41.2" kJ·mol-1
(1)写出催化反应室中三个反应的总反应的热化学方程式: 。
(2)在某温度下,2 L密闭容器中发生反应①,起始时CO、H2的物质的量分别为2 mol和6 mol,3 min后达到平衡,测得CO的转化率为60%,则3 min内CO的平均反应速率为 。若同样条件下起始时CO物质的量为4 mol,达到平衡后CH3OH为2.4 mol,则起始时H2为 mol。
(3)下列有关反应③的说法正确的是 。
A.在体积可变的密闭容器中,在反应③达到平衡后,若加压,则平衡不移动、混合气体平均相对分子质量不变、混合气体密度不变
B.若830 ℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0
C.某温度下,若向已达平衡的反应③中加入等物质的量的CO和H2O(g),则平衡右移、平衡常数变大
(4)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气组成、压强、反应时间等因素不变,实验结果如图,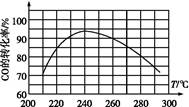
则CO转化率随温度变化的规律是 。
其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________________________
②利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式___________________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
测得CH3OH的物质的量随时间变化如上图所示,回答问题:
①下列措施中能使n(CH3OH)/n(CO2)增大的是________。
| A.升高温度 | B.充入He(g)使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1 mol CO2和3 mol H2 |
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
 ,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
运用化学反应原理研究NH3的性质具有重要意义。请回答下列问题:
(1)氨气、空气可以构成燃料电池.其电池反应原理为4NH3+3O2=2N2+6H2O。则电解质溶液应该显 (填“酸性”“中性”或“碱性”).正极的电极反应式为 。
(2)25℃时.将amol·L—1的氨水与0.1mol·L—1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-))时.则反应的情况可能为 。
A.盐酸不足.氨水剩余 B.氨水与盐酸恰好完全反应 C.盐酸过量
②当溶液中c(NH4+)=c(Cl-))时.用含“a”的代数式表示NH3·H2O的电离平衡常数Kb=______________.
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g) 2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下:
2NH3(g) ?H=bkJ/mol,其化学平衡常数K与温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com