
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
请回答下列问题:
(1)该反应的热化学方程式为_______________________________________________。
(2)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与双氧水反应生成液态水时放出的热量是________ kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________________________________________________________________________________。
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案科目:高中化学 来源: 题型:填空题
工业上常常利用反应①来生产环氧乙烷,但是伴随副反应②。
①C2H4(g)+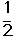 O2(g) →
O2(g) →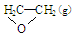 ; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2
; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2
(1)写出环氧乙烷充分燃烧的热化学反应方程式。答:____________________________;
(2)工业生产中,可通过某一措施来加快反应①而对反应②影响较小,从而提高环氧乙烷的生产效率。工业生产采取的这种措施是_______________。
A.升高反应体系的温度B.增大体系中氧气的浓度
C.使用合适的催化剂D.降低反应体系的压强
(3)已知C=C、O=O、C—C键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1,则环氧乙烷中C—O键能为 kJ·mol-1;
(4)反应②可以设计成燃料电池,若以酸做电解质溶液,负极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某实验小组用燃烧分析法测定某有机物中碳和氢等元素的含量,随后又对其进行了性质探究。将已称量的样品置于氧气流中,用氧化铜作催化剂,在高温条件下样品全部被氧化为水和二氧化碳,然后分别测定生成的水和二氧化碳。实验可能用到的装置如下图所示,其中A、D装置可以重复使用。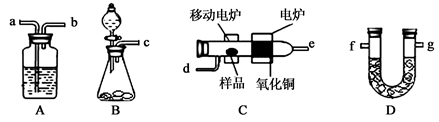
请回答下列问题:
(1)请按气体流向连接实验装置B→ →C→A→D→ (用装置编号填写)。
(2)B装置中制O2时所用的药品是 。实验中,开始对C装置加热之前,要通一段时间的氧气,目的是 ;停止加热后,也要再通一段时间的氧气,目的是 .。
(3)已知取2.3g的样品X进行上述实验,经测定A装置增重2.7g,D装置增重4.4g。试推算出X物质的实验式 。
(4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:实验一:X在一定条件下可催化氧化最终生成有机物Y;实验二:X与Y在浓硫酸加热条件下生成有机物Z。则:①写出实验二中反应的化学方程式 。
② 除去Z中混有的Y所需的试剂和主要仪器是 、 。
(5)若已知室温下2.3g液态X在氧气中完全燃烧生成二氧化碳气体和液态水时可放出68.35kJ的热量,写出X在氧气中燃烧的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
据《辽沈晚报》报道,今年冬天,一旦出现大气严重污染的天气,沈阳市有可能建议政府机关、企事业单位根据实际情况实行员工休假或弹性工作制。大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,,负极反应方程式为:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ?△H=" -556.0" kJ·mol-1
③ H2O(g)=H2O(l)?△H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)在固定容积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H=—92.4kJ/mol,
2NH3(g) △H=—92.4kJ/mol,
其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
 (NH2)2CO +H2O
(NH2)2CO +H2O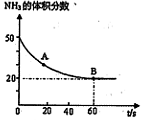
 (CO2) B点的逆反应速率
(CO2) B点的逆反应速率 (CO2)(填写“>”“=”或“<”),NH3的平衡转化率为____ ;
(CO2)(填写“>”“=”或“<”),NH3的平衡转化率为____ ; 2NO(g) △H =+180kJ/mol
2NO(g) △H =+180kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g);ΔH1=+489.0 kJ·mol-1
C(s)+CO2(g)=2CO(g);ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3的热化学方程式为________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题: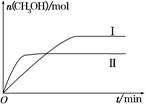
①该反应的平衡常数的表达式为K=________。
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“大于”、“等于”或“小于”)。
③在下图a、b、c三点中,H2的转化率由高到低的顺序是________(填字母)。
(3)在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是________(填序号)。
a.氢气的浓度减小
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反应中,副产物矿渣可用来________。
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)=CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=____________。
(2)(江苏)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)ΔH1=+64.39 kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g)ΔH2=-196.46 kJ·mol-1
③H2(g)+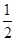 O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)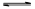 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)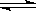 CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)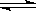 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com