
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________________________
②利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式___________________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
测得CH3OH的物质的量随时间变化如上图所示,回答问题:
①下列措施中能使n(CH3OH)/n(CO2)增大的是________。
| A.升高温度 | B.充入He(g)使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1 mol CO2和3 mol H2 |
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
 ,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
科目:高中化学 来源: 题型:填空题
某实验小组用燃烧分析法测定某有机物中碳和氢等元素的含量,随后又对其进行了性质探究。将已称量的样品置于氧气流中,用氧化铜作催化剂,在高温条件下样品全部被氧化为水和二氧化碳,然后分别测定生成的水和二氧化碳。实验可能用到的装置如下图所示,其中A、D装置可以重复使用。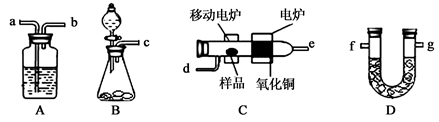
请回答下列问题:
(1)请按气体流向连接实验装置B→ →C→A→D→ (用装置编号填写)。
(2)B装置中制O2时所用的药品是 。实验中,开始对C装置加热之前,要通一段时间的氧气,目的是 ;停止加热后,也要再通一段时间的氧气,目的是 .。
(3)已知取2.3g的样品X进行上述实验,经测定A装置增重2.7g,D装置增重4.4g。试推算出X物质的实验式 。
(4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:实验一:X在一定条件下可催化氧化最终生成有机物Y;实验二:X与Y在浓硫酸加热条件下生成有机物Z。则:①写出实验二中反应的化学方程式 。
② 除去Z中混有的Y所需的试剂和主要仪器是 、 。
(5)若已知室温下2.3g液态X在氧气中完全燃烧生成二氧化碳气体和液态水时可放出68.35kJ的热量,写出X在氧气中燃烧的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反应中,副产物矿渣可用来________。
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)=CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=____________。
(2)(江苏)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)ΔH1=+64.39 kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g)ΔH2=-196.46 kJ·mol-1
③H2(g)+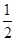 O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
O2(g)=H2O(l)ΔH3=-285.84 kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)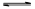 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)如图是在101 kPa、298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO过程中能量变化示意图。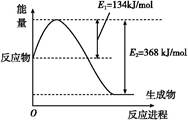
已知:N2(g)+O2(g) 2NO(g) ΔH="+179.5" kJ/mol
2NO(g) ΔH="+179.5" kJ/mol
2NO(g)+O2(g) 2NO2(g) ΔH="-112.3" kJ/mol
2NO2(g) ΔH="-112.3" kJ/mol
则在298 K时,反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的ΔH= 。
N2(g)+2CO2(g)的ΔH= 。 
(2)将0.20 mol NO2和0.10 mol CO 充入一个容积恒定为1 L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K值增大
c.升高温度后,K值减小,NO2的转化率减小
d.向该容器内充入He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO2在0~2 min时平均反应速率v(NO2)= mol/(L·min)。
③第4 min时改变的反应条件为 (填“升温”或“降温”)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充入CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。 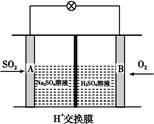
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极的反应式为 ,当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 。
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。现将2×10-4 mol/L的Na2CO3溶液与一定浓度的CaCl2溶液等体积混合生成沉淀,计算应加入CaCl2溶液的最小浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为________;
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l)
ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)
ΔH2=-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式________________________;
(3)已知H2O(l)=H2O(g) ΔH3=+44 kJ·mol-1,则表示肼燃烧热的热化学方程式为________________________。
(4)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要作用。
(1)真空碳热还原一氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+ 2AlCl3(g)+ 6C(s)=6AlCl(g)+ 6CO(g);△H= a kJ?mol-1
3AlCl(g)= 2Al(l)+ AlCl3(g);△H= b kJ?mol-1
反应Al2O3(s)+ 3C(s)= 2Al(l)+ 3CO(g)的△H= kJ?mol-1
(用含a、b的代数式表示)。
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)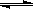 N2(g)+ CO2(g);△H= Q kJ?mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+ CO2(g);△H= Q kJ?mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)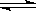 CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)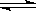 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+2AlCl3(g)+6C(s) = 6AlCl(g)+6CO(g) ΔH=a kJ·mol-1
②3AlCl(g) = 2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
反应:Al2O3(s)+3C(s)=2Al(l)+3CO(g)的ΔH = kJ·mol-1 (用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g) ΔH ="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH ="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间/min 浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com