
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1)利用H2 和CO在一定条件下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
①10min后达到平衡时CO的浓度为 ;
②10min内用H2表示的平均反应速率为 ;
③若要加快CH3OH的生成速率,可采取的措施有 (填一种合理的措施)
(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
①已知:4.4gCO2与H2完全转化为CH2=CH2和水(气态)共放出6.39kJ的热量,写出该反应的热化学方程式 。
②不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。
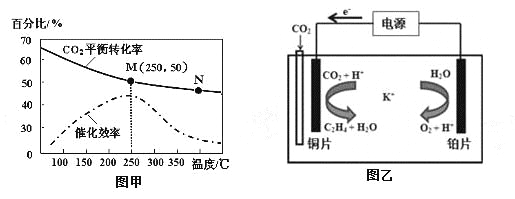
下列有关说法不正确的是 (填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
③若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为 。(保留两位有效数字)
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为 。
【答案】1)①0. 4mol/L(2)②0.04mol/(L.min)
③增大压强(升高温度、使用催化剂等合理均可)
(2)①6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g) △H=-127.8 kJ/mol
CH2=CH2(g)+4H2O(g) △H=-127.8 kJ/mol
②a ③7.7% 或0.077 (3)2CO2+12H++12e﹣=CH2=CH2+4H2O
【解析】试题分析:(1) CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度mol/L:0.6 0.5 0
转化浓度mol/L: 0.2 0.4 0.2
平衡浓度mol/L: 0.4 0.1 0.2
① 10min后达到平衡时CO的浓度为0.4mol/L;②10min内用H2表示的平均反应速率为:v=![]() =
=![]() =0.04mol/(L.min);③若要加快CH3OH的生成速率,可采取的措施有:增大压强(升高温度、使用催化剂等等)
=0.04mol/(L.min);③若要加快CH3OH的生成速率,可采取的措施有:增大压强(升高温度、使用催化剂等等)
(2)①4.4gCO2与H2完全转化为CH2=CH2和水(气态)共放出6.39kJ的热量,2mol二氧化碳放出127.8 kJ 的热量,则热化学方程式为:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)△H=-127.8 kJ/mol;②a.N点的温度高,但是,催化剂的效率低,速率不一定最大,错误;b.根据图象,温度在约250℃时,催化剂的催化效率最高,正确;c.根据图象,当温度高于250℃,升高温度二氧化碳的平衡转化率减低,则平衡逆向移动,乙烯的产量M点比N高,正确;故选a;
CH2=CH2(g)+4H2O(g)△H=-127.8 kJ/mol;②a.N点的温度高,但是,催化剂的效率低,速率不一定最大,错误;b.根据图象,温度在约250℃时,催化剂的催化效率最高,正确;c.根据图象,当温度高于250℃,升高温度二氧化碳的平衡转化率减低,则平衡逆向移动,乙烯的产量M点比N高,正确;故选a;
③设开始投料n(H2)为3mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%,所以有6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g)
开始 3 1 0 0
转化 1.5 0.5 0.25 1
平衡 1.5 0.5 0.25 1
所以乙烯的体积分数为:0.25÷(1.5+0.5+0.25+1)×100%=7.7%;
(3)CO2在阴极上得电子生成乙烯,所以其电极反应方程式为:2CO2+12H++12e﹣== CH2=CH2+4H2O。


科目:高中化学 来源: 题型:
【题目】用自来水养金鱼,在将水注入鱼缸之前,常须把水在阳光下曝晒一段时间,其目的是( )
A.增加水中的含氧量
B.起到杀菌作用
C.使水中的次氯酸分解
D.使水的硬度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得,某有机物A相对分子质量为72。
(1)若A是烃,其分子式为______,它有_____种同分异构体,沸点最高的是__________________ (写结构简式)。若该烃与Cl2发生取代反应,生成的一氯代物只有1种,则该A的结构简式为______。
(2)若该有机物3.6g完全燃烧生成0.15molCO2和0.1molH2O,则A的分子式为_______。若它是一种不饱和羧酸,该酸与甲醇发生酯化反应的化学方程式为(注明反应条件):__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
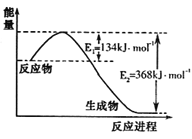
(1)下图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在一定体积的密闭容器中,进行如下化学反应: N2(g)+3H2(g)![]() 2NH3(g)△H <0,
2NH3(g)△H <0,
其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | … |
K/(mol·L-1) | 4.1×106 | K1 | K2 | … |
完成下列问题:
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆)
B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O]+)> c(H+)>c(OH-)
C.2 c(N2H62+)+ c([N2H5·H2O]+)+ c(H+)= c(Cl-)+ c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1) E的元素名称是 ,乙的电子式为 。
(2)写出甲的化学式 ,该化合物中存在的化学键有
(3) C、D、E三种元素的离子半径由大到小的顺序是 (用离子符号填写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修2:化学与技术)熔炼法是工业上回收镁合金废料的常用方法,其流程为:
![]()
(1)废料预处理
①粉碎:有干态机械粉碎法和湿喷机械粉碎法,其中容易造成危险的方法是 ,理由是 。
②除油污和油漆:把油污和油漆一次性除去最适宜的方法是 。
a.用热碱洗涤,过滤
b.用有机溶剂溶解,过滤
c.加热气化除去
(2)镁合金在加热到935K时熔化,并不断向其中通入氩气做保护气。若用二氧化碳做保护气,可能造成的后果是 (用化学方程式表示)。
(3)熔融镁中的杂质铁可加入固体硼砂(B2O3)除去,生成FeB2沉渣,其化学反应方程式为 。
(4)镁合金除了含有铁之外,还含有少量铝。加入C2Cl6可以除去液态镁中的氢气,还能把铝转化为Al4 C3沉渣:
C2Cl6=2C+3Cl2 3C+4Al=Al4C3
①除气除渣炉排出的污染性气体有 。
②如果1t镁合金中,铝占3.6‰,则除去铝最少需要加入C2Cl6 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是
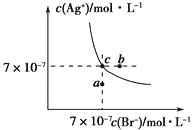
A. 在t℃时,AgBr的Ksp为4.9×10-13
B. 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C. 图中a点对应的是AgBr的不饱和溶液
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.煤的干馏是化学变化
B.煤液化后可以得到甲醇等液体燃料
C.煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来
D.从萃取分液后溴的四氯化碳溶液中提取溴可以用蒸馏的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某研究性学习小组为了验证CH4是否具有还原性,设计了如下实验:
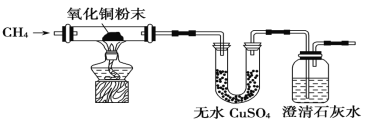
(1)实验过程中观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为____ __ 。
(2)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是____ 。
请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图)___ ________ _____ 。
II、(1)工业上用电石-乙炔生产氯乙烯的反应如下:CaO+3C![]() CaC2+CO
CaC2+CO
CaC2+2H2O![]() CH≡CH+Ca(OH)2 CH≡CH+HCl
CH≡CH+Ca(OH)2 CH≡CH+HCl ![]() CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖与石油资源。
电石-乙炔法的缺点是: 、 。
(2)已知ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。请设计以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com