
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1) E的元素名称是 ,乙的电子式为 。
(2)写出甲的化学式 ,该化合物中存在的化学键有
(3) C、D、E三种元素的离子半径由大到小的顺序是 (用离子符号填写)。
【答案】(1)铝;![]()
(2)Na2O;离子键
(3)Na+>Mg2+>Al3+
【解析】试题分析:A、B、C、D、E都是短周期元素,原子序数依次增大,C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙,则C为钠元素,B为氧元素;A、B处于同一周期,A原子的最外层电子数比次外层电子数多3个,则A为氮元素;C、D、E同处另一周期,E是地壳中含量最高的金属元素,则E为铝元素,D为镁元素。
(1)E的元素名称是铝;乙为过氧化钠,其电子式为:![]() 。
。
故答案为:铝;![]() ;
;
(2)甲为氧化钠,其化学式为:Na2O;Na2O属于离子化合物,化合物中只存在离子键。
故答案为:Na2O;离子键;
(3)C为钠元素,D为镁元素,E为铝元素,三种元素的离子电子层结构完全相同,原子序数越大其离子半径越小。所以,离子半径由大到小的顺序是:Na+>Mg2+>Al3+。
故答案为:Na+>Mg2+>Al3+。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为4种短周期元素。已知:①X、W同主族,Y、Z同主族;②X、Y可形成两种液态化合物X2Y和X2Y2;③X2Z和ZY2之间可发生反应生成Z单质;④W2Y2和X2Y之间可发生反应生成Y单质。
请完成下列问题:
(1)X、Y元素的名称为X________,Y________。
(2)写出W2Y2的电子式:__________,Z的原子结构示意图为__________。
(3)写出④ 中反应的化学方程式__ ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同:D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为25。
(1)F基态原子的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是(用元素符号回答) 。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知;还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图。下列说法正确的是()

A.反应过程中的氧化产物均为Na2SO4
B.a 点时消耗NaHSO3的物质的量为1.0mol
C.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
D.当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1)利用H2 和CO在一定条件下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
①10min后达到平衡时CO的浓度为 ;
②10min内用H2表示的平均反应速率为 ;
③若要加快CH3OH的生成速率,可采取的措施有 (填一种合理的措施)
(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
①已知:4.4gCO2与H2完全转化为CH2=CH2和水(气态)共放出6.39kJ的热量,写出该反应的热化学方程式 。
②不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。
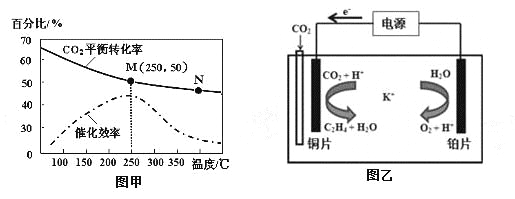
下列有关说法不正确的是 (填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
③若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为 。(保留两位有效数字)
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用下图装置进行乙酸乙酯合成和分离的实验探究,请回答以下问题

(1)写出合成乙酸乙酯的化学方程式____________________________________。
(2)仪器b的名称________,图中起冷凝回流作用的是______(填a、b、c、d、e)。
(3)为了提高乙酸乙酯的产率可采取的措施 ___________________________________
(4)经过0.5h加热反应后,将反应装置c中粗产品转移至d中进行蒸馏
物质 | 98.3%浓硫酸 | 乙酸乙酯 | 乙酸 | 乙醇 | 乙醚 | 水 |
沸点 | 338℃, | 77.1℃ | 118℃ | 78.5℃ | 34.6℃ | 100℃ |
根据上表分析,蒸馏后得到的乙酸乙酯中,最有可能含有________________杂质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铁制品上镀上一定厚度的铜层,以下电镀方案中正确的是 ( )
A. 铜作阳极,铁制品作阴极,溶液中含Fe2+
B. 铜作阴极,铁制品作阳极,溶液中含Cu2+
C. 铜作阴极,铁制品作阳极,溶液中含Fe3+
D. 铜作阳极,铁制品作阴极,溶液中含Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质。
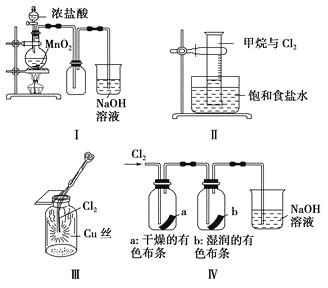
下列说法正确的是
A. Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B. Ⅱ图中:量筒中发生了加成反应
C. Ⅲ图中:生成蓝色的烟
D. Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com