
【题目】鸦片最早用于药物(有止痛、止泻、止咳的作用),长期服用会成瘾,使人体质衰弱,精神颓废,寿命缩短.鸦片具有复杂的组成,其中的罂粟碱的分子结构如下: 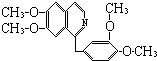 已知该物质的燃烧产物为CO2、H2O和N2 , 1mol该化和物完全燃烧消耗的O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物的同分异构体的种数分别为( )
已知该物质的燃烧产物为CO2、H2O和N2 , 1mol该化和物完全燃烧消耗的O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物的同分异构体的种数分别为( )
A.23.25mol 5
B.24.5mol 7
C.24.5mol 8
D.23.25mol 6
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( ) 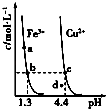
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
C.加适量NH4Cl固体可使溶液由a点变到b点
D.c、d两点代表的溶液中c(H+)与c(OH﹣)乘积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 微量元素就是可有可无的元素
B. 微量元素主要是指Cu、Fe、B、Mn等
C. 缺少微量元素生命活动要受到影响
D. 微量元素也是生命和非生物界共有的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物的结构简式为 ,下列关于该化合物的说法不正确的是
,下列关于该化合物的说法不正确的是
A. 该有机物的分子式为C23H24O6
B. 1mol该化合物最多可以与9molH2发生加成反应
C. 既可以使溴的四氯化碳溶液褪色,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硫酸被人们誉为“化学工业之母”,在国民生产中发挥着重要作用。硫酸的性质有:A.高沸点;B.强酸性;C.吸水性;D.脱水性;E.强氧化性。在下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空:
①硫酸可用作气体干燥剂___________;
②往晶体硫酸铜中加液硫酸,晶体变白___________;
③浓硫酸使湿润蓝色石蕊试纸先变红后又变黑___________;
④浓硫酸使蔗糖变黑,且有刺激性气味的气体产生___________;
⑤浓硫酸与FeO反应____________;
⑥运用铁制槽车和铝制槽车送输浓硫酸___________。
(2)“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。煤燃烧排放的烟气含有SO2和NOx,形成酸雨,汚染大气,采用NaClO2溶液在碱性条件下可对烟气迸行脱硫、脱硝,效果非常好。
①完成下列对烟气脱硝过程的离子方程式
___C1O2-+__NO+____=Cl-+____NO3-+______。
②SO2有多种处理方式,写出用过量氨水吸收尾气的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:
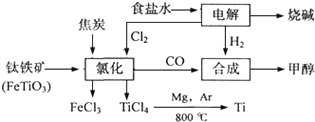
(1)写出钛铁矿经氯化法得到四氯化钛的化学方程式:_____________________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s);△H=﹣641kJmol﹣1
②Ti(s)+2Cl2(g)=TiCl4(s);△H=﹣770kJmol﹣1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);△H=___________________________。反应2Mg+TiCl4![]() 2MgCl4+Ti在Ar气氛中进行的理由是_______________________。
2MgCl4+Ti在Ar气氛中进行的理由是_______________________。
(3)在上述产业链中,合成192t甲醇理论上需额外补充H2___________t(不考虑生产过程中物质的任何损失).
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是广泛存在于环境中的金属元素,在水体中主要以三价和六价铬的化合物为主,其中六价铬对人有害。通常含六价铬的酸性工业废水的处理流程为:
![]()
请回答下列问题:
I.(1)第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
a.Cr2O72-和CrO42-的浓度相同 b.2v (Cr2O72-) = v (CrO42-) c.溶液的颜色保持不变
(2)常温下,向100mL、0.1mol/L的K2CrO4溶液加入1mol/L硫酸10mL,存在平衡:
2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O K=5×1014
Cr2O72-(橙色)+H2O K=5×1014
若向上述溶液中加入浓KOH溶液,溶液的颜色由橙色渐变为黄色,反应逆转:Cr2O72-(橙色) +2OH-![]() 2CrO42-(黄色) +H2O
2CrO42-(黄色) +H2O
设该反应的平衡常数为K1,则K1=_______________。
II.为进一步研究初始pH和草酸浓度对第②步反应速率的影响,某学习小组设计对比实验如下表:
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
甲 | 4 | 60 | 10 | 30 |
乙 | 5 | x | 10 | 30 |
丙 | 5 | y | 5 | z |
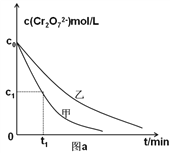
(3)实验设计表中z=_______mL;
(4)实验甲中0~t1时间段反应速率v(Cr3+)=________mol/(L·min) (用含字母的代数式表示)。
(5)常温下,第③步生成的Cr(OH)3在溶液中存在以下平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。
Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) △H1
O2(g)=H2O(g) △H1
![]() N2(g)+O2(g)=NO2(g) △H2
N2(g)+O2(g)=NO2(g) △H2
![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) △H3
H2(g)=NH3(g) △H3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的△H为
O2(g)=2NO2(g)+3H2O(g)的△H为
A. 2△H1+2△H2-2△H3 B. △H1+△H2-△H3
C. 3△H1+2△H2+2△H3 D. 3△H1+2△H2-2△H3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com