
【题目】(1)硫酸被人们誉为“化学工业之母”,在国民生产中发挥着重要作用。硫酸的性质有:A.高沸点;B.强酸性;C.吸水性;D.脱水性;E.强氧化性。在下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空:
①硫酸可用作气体干燥剂___________;
②往晶体硫酸铜中加液硫酸,晶体变白___________;
③浓硫酸使湿润蓝色石蕊试纸先变红后又变黑___________;
④浓硫酸使蔗糖变黑,且有刺激性气味的气体产生___________;
⑤浓硫酸与FeO反应____________;
⑥运用铁制槽车和铝制槽车送输浓硫酸___________。
(2)“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。煤燃烧排放的烟气含有SO2和NOx,形成酸雨,汚染大气,采用NaClO2溶液在碱性条件下可对烟气迸行脱硫、脱硝,效果非常好。
①完成下列对烟气脱硝过程的离子方程式
___C1O2-+__NO+____=Cl-+____NO3-+______。
②SO2有多种处理方式,写出用过量氨水吸收尾气的离子方程式:_____________________。
【答案】 C C BD DE BE E 3ClO2-+4NO+4OH-=3Cl-+4NO3-+2H2O SO2+2NH3·H2O=2NH+SO![]() +H2O
+H2O
【解析】分析:(1)依据硫酸的性质有:高沸点、强酸性、吸水性、脱水性、强氧化性,再结合相关物质的性质分析解答;
(2)①根据电子得失守恒配平;
②氨水过量生成亚硫酸铵。
详解:(1)①硫酸具有吸水性,因此可用作气体干燥剂,答案选C;
②胆矾遇浓硫酸变白色,体现浓硫酸的吸水性,答案选C;
③硫酸显酸性,而浓硫酸又具有脱水性,因此浓硫酸使湿润蓝色石蕊试纸先变红后又变黑,答案选BD;
④浓硫酸具有脱水性,使蔗糖变黑,又因为浓硫酸还具有强氧化性,则碳粉与热的浓硫酸反应放出二氧化碳和有刺激性气味的二氧化硫气体,答案选DE;
⑤浓硫酸与FeO反应生成硫酸铁、SO2和水,体现浓硫酸的酸性和强氧化性,答案选BE;
⑥浓硫酸具有强氧化性,常温下能够使铁、铝发生钝化,所以可用铁制槽车和铝制槽车送输浓硫酸,答案选E;
(2)①反应中氮元素化合价从+2价升高到+5价,失去3个电子。氯元素化合价从+3价降低到-1价,得到4个电子,根据电子得失守恒以及原子守恒、电荷守恒可知反应的方程式为3C1O2-+4NO+4OH-=3Cl-+4NO3-+2H2O;
②用过量氨水吸收尾气生成亚硫酸铵,反应的离子方程式为SO2+2NH3·H2O=2NH4++SO32-+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列说法错误的是( ) 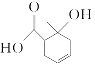
A.与乙酸互为同系物
B.含有两种含氧官能团
C.可使Br2的CCl4溶液褪色
D.既可以发生取代反应又可以发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鸦片最早用于药物(有止痛、止泻、止咳的作用),长期服用会成瘾,使人体质衰弱,精神颓废,寿命缩短.鸦片具有复杂的组成,其中的罂粟碱的分子结构如下: 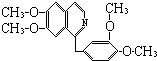 已知该物质的燃烧产物为CO2、H2O和N2 , 1mol该化和物完全燃烧消耗的O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物的同分异构体的种数分别为( )
已知该物质的燃烧产物为CO2、H2O和N2 , 1mol该化和物完全燃烧消耗的O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物的同分异构体的种数分别为( )
A.23.25mol 5
B.24.5mol 7
C.24.5mol 8
D.23.25mol 6
查看答案和解析>>
科目:高中化学 来源: 题型:
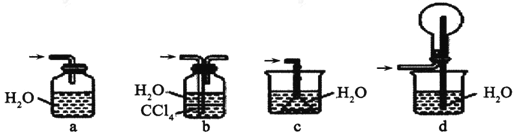
【题目】氨气是一种重要化合物,在工农业生产、生活中有重要作用。利用下图探究氨气的性质。
(1)收集气体,按下图玻璃装置进行实验。先打开旋塞①,B瓶中产生白色的烟,原因是______(用化学方程式表示);稳定后,关闭旋塞①,再打开旋塞②,B瓶中的现象是________。

(2)若将氯气和氨气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:________,该反应生成的还原产物的化学键类型是________。
(3)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去):

①A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是_______。
②C装置中发生反应的化学方程式为________。
③反应后,装置E中除存在较多的H+外,还可能存在的一种离子是______,试设计实验证明这种离子的存在________。
④下列哪些装置可以同时起到装置D和E的作用_______ (填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是实验操作,能达到实验目的是( )
A. 用25.00mL碱式滴定管量取14.80mLNaOH溶液
B. 用100mL量筒量取5.2mL盐酸
C. 用托盘天平称取25.20g氯化钠
D. 用100mL容量瓶配制50mL0.1mol·L-1盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗铜中一般含有锌、铁、银、金等杂质。在下图所示的装置中,甲池的总反应方程式为2CH3OH+3O2+4KOH=2K2CO3+6H2O。接通电路一段时间后,纯Cu电极质量增加了3.2g。在此过程中,下列说法正确的是
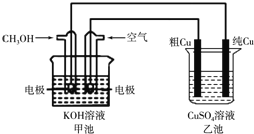
A. 乙池中CuSO4溶液的浓度不变
B. 甲池中理论上消耗标准状况下空气的体积是2.8L(空气中O2体积分数以20%计算)
C. 甲池是电能转化为化学能的装置,乙池是化学能转化为电能的装置
D. 甲池通入CH3OH一极的电极反应为:CH3OH-6e-+2H2O=CO32-+8H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com