
����Ŀ����ͭ��һ�㺬��п����������������ʡ�����ͼ��ʾ��װ���У��׳ص��ܷ�Ӧ����ʽΪ2CH3OH��3O2��4KOH��2K2CO3��6H2O����ͨ��·һ��ʱ���Cu�缫����������3.2g���ڴ˹����У�����˵����ȷ����
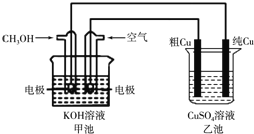
A. �ҳ���CuSO4��Һ��Ũ�Ȳ���
B. �׳������������ı�״���¿����������2.8L��������O2���������20%���㣩
C. �׳��ǵ���ת��Ϊ��ѧ�ܵ�װ�ã��ҳ��ǻ�ѧ��ת��Ϊ���ܵ�װ��
D. �׳�ͨ��CH3OHһ���ĵ缫��ӦΪ��CH3OH��6e����2H2O��CO32����8H��
���𰸡�B
��������������A���ҳ�Ϊ��ͭ�ĵ�⾫�������ݵ��ԭ��������
B������ת�Ƶ����غ�������Ŀ��������
C���׳���ԭ��ء��ҳ��ǵ��أ�
D��ͨ��״��ĵ缫�Ǹ����������ϼ״�ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ��
��⣺A���ҳ�Ϊ��ͭ�ĵ�⾫������ͭ�缫��Cu����������ʧ���ӡ���ͭ������������ֻ��Cu��������Һ��ͭ���Ӽ��٣�����Һ��ͭ����Ũ�Ƚ��ͣ�A����
B��3.2gͭ�����ʵ�����0.05mol��ת�Ƶ�����0.1mol��������·��ת�Ƶ�����ȣ�����3.2gͭת�Ƶ��ӵ����ʵ���=�����õ��ӵ����ʵ���������Ҫ������0.1mol��4��0.025mol���������Ŀ������Ϊ0.025mol��5��22.4L/mol��2.8L��B��ȷ��
C���׳���ԭ��ء��ҳ��ǵ��أ����Լ׳��ǽ���ѧ��ת��Ϊ���ܵ�װ�á��ҳ��ǽ�����ת��Ϊ��ѧ�ܵ�װ�ã�C����
D��ͨ��״��ĵ缫�Ǹ����������ϼ״�ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ���缫��ӦʽΪCH3OH-6e-+8OH-��CO32-+6H2O��D����ѡB��


 ����Ӣ��ϵ�д�
����Ӣ��ϵ�д� ����ѧУ�ֲ����ܲ�ϵ�д�
����ѧУ�ֲ����ܲ�ϵ�д� �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)���ᱻ������Ϊ����ѧ��ҵ֮ĸ�����ڹ��������з�������Ҫ���á������������:A.�߷е㣻B.ǿ���ԣ�C.��ˮ�ԣ�D.��ˮ�ԣ�E.ǿ�����ԡ��������������;��ѧ��Ӧ�У�������ܱ���������һ�����߶�����ʣ�������ĸ���:
�������������������___________��
������������ͭ�м�Һ���ᣬ������___________��
��Ũ����ʹʪ����ɫʯ����ֽ�ȱ����ֱ��___________��
��Ũ����ʹ���DZ�ڣ����д̼�����ζ���������___________��
��Ũ������FeO��Ӧ____________��
���������Ʋ۳������Ʋ۳�����Ũ����___________��
(2)����ˮ��ɽ���ǽ�ɽ��ɽ��������������ɫ��չ����̬������Ϊ�й�չʾ�������һ���¡���Ƭ����úȼ���ŷŵ���������SO2��NOx���γ����꣬�AȾ����������NaClO2��Һ�ڼ��������¿ɶ�������������������Ч���dz��á�
��������ж������������̵����ӷ���ʽ
___C1O2-+__NO+____=Cl-+____NO3-+______��
��SO2�ж��ִ�����ʽ��д���ù�����ˮ����β�������ӷ���ʽ:_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������һ�����ォ��ˮ�е��л���(�����)�ͷ���NO�Ļ�ѧ��ֱ��ת��Ϊ���ܣ�����˵����һ����ȷ����
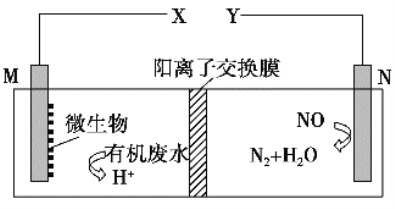
A. �����������ӽ���Ĥ���������ƶ�
B. ��X���������õ��������������Ľ�����
C. M�缫��Ӧʽ��(C6H10O5)n��7nH2O��24ne��===6nCO2����24nH��
D. ��M�缫���ォ��ˮ��16.2 g����ת����ʱ��N�缫����134.4 L N2������£�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������̼����ȼ�ϵ����Li2CO3��K2CO3Ϊ����ʡ���CH4Ϊȼ��ʱ���õ�ع���ԭ����ͼ������˵����ȷ����
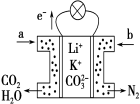
A��aΪO2��bΪCH4
B��CO 32-�������ƶ�
C���˵���ڳ���ʱҲ�ܹ���
D�������缫��ӦʽΪ2CO2+O2+4e����2CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������������о�����Ҫ�����ã�̼ԭ�ӱ����Ļ�ѧ���ʣ������ܹ�ͨ����ѧ�����ӳ������Ӷ��γɸ����������ӡ�����˵�������ϵ���������̼Ԫ�صĻ����Ͻ��������ġ�������ʵ����˵��
A. ̼Ԫ����ɸ��ָ����Ļ����� B. ̼Ԫ���������������Ԫ��
C. ̼Ԫ���Ǹ��ִ�����к�������Ԫ�� D. ̼Ԫ�۱�����Ԫ����ˣ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��H2��g����![]() O2��g����H2O��g�� ��H1
O2��g����H2O��g�� ��H1
![]() N2��g����O2��g����NO2��g�� ��H2
N2��g����O2��g����NO2��g�� ��H2
![]() N2��g����
N2��g����![]() H2��g����NH3��g�� ��H3
H2��g����NH3��g�� ��H3
��Ӧ2NH3��g����![]() O2��g����2NO2��g����3H2O��g������HΪ
O2��g����2NO2��g����3H2O��g������HΪ
A. 2��H1��2��H2��2��H3 B. ��H1����H2����H3
C. 3��H1��2��H2��2��H3 D. 3��H1��2��H2��2��H3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��R��Q�Ƕ���������Ԫ�أ�������Ϣ���±���ʾ��
X | Y | Z | M | R | Q | |
ԭ�Ӱ뾶 | 0.186 | 0.074 | 0.099 | 0.143 | ||
��Ҫ���ϼ� | ��4����4 | ��2 | ��1����7 | ��3 | ||
���� | ������������� | ���ǽ������ϵ����� | ��ɫ��Ӧ�ʻ�ɫ |
��1��X��M��ԭ�ӿɹ���18���ӵķ��ӣ��÷��ӵķ���ʽΪ______________��
��2��Z��Q��ȣ������Խ�ǿ����______________����Ԫ�ط��ű�ʾ����������ʵ��֤��һ���۵���______________������ĸ���ţ���
A.Q���۵��Z���۵�ߣ�Q��Ӳ�ȱ�Z��Ӳ�ȴ�
B.Z����ˮ��ӦѸ�٣���Q����ˮ��������Ӧ
C.Z������������Ӧˮ������ǿ���Q������������Ӧˮ�����������
��3����YԪ��ͬ����Ķ�����Ԫ��E����Ȼ���д��ڶ��ֺ��أ�����֮��Ĺ�ϵ��Ϊ_______________��
��4��д��Z2M2�ĵ���ʽ��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. 1molCl2����ˮ����Һ��Cl2��HClO��ClO-��Cl-������������Ϊ2NA
B. 6.4gCu������Ũ���ᷴӦ����NO2������ĿΪNA
C. 1mol����(C6H10O5)nˮ�������������Ƿ�����ĿΪNA
D. ��״���£�2molNa2O2��44.8LSO2��ȫ��Ӧ��ת�Ƶĵ�����ĿΪ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4A��s��+3B��g���T2C��g��+D��g������2min��B��Ũ�ȼ���0.6mol/L���Դ˷�Ӧ���ʵı�ʾ��ȷ���ǣ�������
A.��A��ʾ�ķ�Ӧ������0.4 mol��Lmin����1
B.�ֱ���B,C,D��ʾ�ķ�Ӧ�������ֵ��3��2��1
C.��2minĩ�ķ�Ӧ���ʣ���B��ʾ��0.3 mol��Lmin����1
D.����2min����B��C��ʾ�ķ�Ӧ���ʵ�ֵ������С��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com