
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是
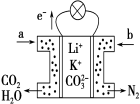
A.a为O2,b为CH4
B.CO 32-向正极移动
C.此电池在常温时也能工作
D.正极电极反应式为2CO2+O2+4e-=2CO32-
科目:高中化学 来源: 题型:
【题目】下列是实验操作,能达到实验目的是( )
A. 用25.00mL碱式滴定管量取14.80mLNaOH溶液
B. 用100mL量筒量取5.2mL盐酸
C. 用托盘天平称取25.20g氯化钠
D. 用100mL容量瓶配制50mL0.1mol·L-1盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝等金属单质及其化合物在生产和生活中有着广泛的应用。
(1)金属冶炼与处理常涉及氧化还原反应,由下列物质冶炼相应金属单质时采用电解法的是_________。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。

为防止金属Fe被腐蚀,可以采用上述_______(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为______________________________________________。
(3)利用甲醇(CH3OH)、氧气组成燃料电池,电解质溶液为碱性,电池工作时负极反应式为_____________。
(4)氨气也可作为燃料电池的燃料源制成高效率无污染的燃料电池系统,总反应式为:![]() (未配平),写出此碱性燃料电池的负极反应式:_______。
(未配平),写出此碱性燃料电池的负极反应式:_______。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_________________________。
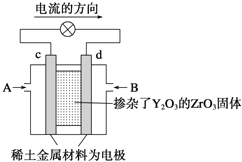
(6)科学家制造出一种使用固体电解质的燃料电池,其效率高无污染,多用于航天航空。如图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导阳极生成的O2-(O2+4e-=2O2-),d电极上的电极反应式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍. 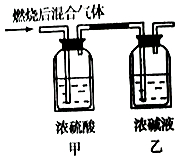
回答下列问题:
(1)该烃的相对分子质量是 , 分子式是 .
(2)若该烃为链状烃,写出所有同分异构体的结构简式(不考虑顺反异构) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液(此时不考虑CO32-的水解),滴加过程中溶液中-lgc(Ca2+)与Na2CO3 溶液体积(V)的关系如图所示,下列有关说法正确的是

A. z 点对应的分散系很稳定
B. w、x、y三点中,水的电离程度最大的为w点
C. 若用等浓度的Na2SO4溶液代替Na2CO3溶液,则图像在x点后的变化如虚线部分所示
D. 此温度下,Ksp(CaCO3)=1x10-8.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗铜中一般含有锌、铁、银、金等杂质。在下图所示的装置中,甲池的总反应方程式为2CH3OH+3O2+4KOH=2K2CO3+6H2O。接通电路一段时间后,纯Cu电极质量增加了3.2g。在此过程中,下列说法正确的是
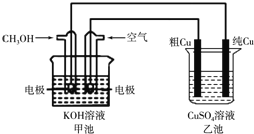
A. 乙池中CuSO4溶液的浓度不变
B. 甲池中理论上消耗标准状况下空气的体积是2.8L(空气中O2体积分数以20%计算)
C. 甲池是电能转化为化学能的装置,乙池是化学能转化为电能的装置
D. 甲池通入CH3OH一极的电极反应为:CH3OH-6e-+2H2O=CO32-+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型电池的工作原理如图所示,放电时总反应为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2,下列说法错误的是

A. 放电时,正极的电极反应式为NiO(OH)+e-+H2O=Ni(OH)2+OH-
B. 充电时,阳极的电极反应式为AlO2--3e-+2H2O=A1+4OH-
C. 放电时,Na+向正极移动
D. 充电时,当电路中通过3NA电子时,阳极质量减少3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4在工业中有重要应用。用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:
I.向软锰矿浆中通入SO2,锰、铁、铝、铅元素以离子形式浸出,测得浸出液的pH<2。
II.向浸出液中加MnO2,充分反应后,加入石灰乳,调溶液pH = 4.7。
III.再加入阳离子吸附剂,静置后过滤。
IV.滤液蒸发浓缩,冷却结晶,获得MnSO4晶体。
【资料】部分阳离子形成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(1)I中向软锰矿浆中通入SO2生成MnSO4,该反应的化学方程式是________。
(2)II中加入MnO2的主要目的是________;调溶液 pH=4.7,生成的沉淀主要含有________和少量CaSO4。
(3)III中加入阳离子吸附剂,主要除去的离子是________。
(4)用惰性电极电解MnSO4溶液,可以制得高活性MnO2。
①电解MnSO4溶液的离子方程式是________。
②高活性MnO2可用于催化降解甲醛,有关微粒的变化如下图所示,其中X是________,总反应的化学方程式是________。
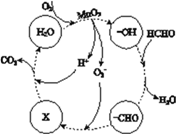
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com