
【题目】燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍. 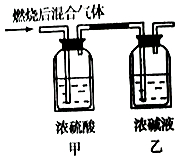
回答下列问题:
(1)该烃的相对分子质量是 , 分子式是 .
(2)若该烃为链状烃,写出所有同分异构体的结构简式(不考虑顺反异构) .
【答案】
(1)56; C4H8
(2)CH2=CHCH2CH3、CH3CH=CHCH3、CH3C(CH3)=CH2
【解析】解:甲装置增重3.6g为该有机物燃烧生成水的质量,则水的物质的量n(H2O)= ![]() =0.2mol,n(H)=2n(H2O)=0.4mol,
=0.2mol,n(H)=2n(H2O)=0.4mol,
乙装置中浓碱液增加的质量就是该有机化合物燃烧所产生的二氧化碳的质量,二氧化碳的物质的量为:n(CO2)= ![]() =0.2mol,n(C)=n(CO2)=0.2mol,
=0.2mol,n(C)=n(CO2)=0.2mol,
C、H,原子个数比为12,又知该烃的蒸汽密度是同温同压下氢气密度的28倍,则M=28×2=56,设分子式为(CH2)x,则14x=56,解得x=4,(1)该烃的相对分子质量是56,分子式是C4H8,所以答案是:56;C4H8;(2)若该烃为链状烃,所有同分异构体的结构简式(不考虑顺反异构)为CH2=CHCH2CH3、CH3CH=CHCH3、CH3C(CH3)=CH2,
所以答案是:CH2=CHCH2CH3、CH3CH=CHCH3、CH3C(CH3)=CH2.


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH4的二氯代物只有一种,此事实可说明CH4为正四面体结构
B.光照条件下,1 mol甲烷和氯气完全取代需要2 mol氯气
C.C6H14的同分异构体有4种
D.正戊烷和异戊烷属于同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(如淀粉)和废气NO的化学能直接转化为电能,下列说法中一定正确的是
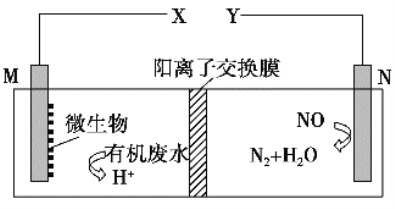
A. 质子透过阳离子交换膜由右向左移动
B. 与X相连接是用电器标有“+”的接线柱
C. M电极反应式:(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+
D. 当M电极微生物将废水中16.2 g淀粉转化掉时,N电极产生134.4 L N2(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牛通过吃草从草中获得化合物和元素,那么,牛和草体内的各种化学元素( )
A. 种类差异很大,含量大体相同
B. 种类和含量差异都很大
C. 种类和含量都是大体相同的
D. 种类大体相同,含量差异很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是
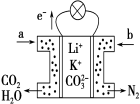
A.a为O2,b为CH4
B.CO 32-向正极移动
C.此电池在常温时也能工作
D.正极电极反应式为2CO2+O2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物大分子在生物体的生命活动中具有重要的作用,碳原子本身的化学性质,是它能够通过化学键连接成链或环,从而形成各种生物大分子。可以说,地球上的生命处在碳元素的基础上建立起来的。以上事实可以说明
A. 碳元素组成各种各样的化合物 B. 碳元素是生命的最基本元素
C. 碳元素是各种大分子中含里最多的元素 D. 碳元聚比其他元素重耍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | Q | |
原子半径 | 0.186 | 0.074 | 0.099 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
其他 | 阴离子无核外电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)X和M的原子可构成18电子的分子,该分子的分子式为______________。
(2)Z与Q相比,金属性较强的是______________(用元素符号表示),下列事实能证明一结论的是______________(填字母符号)。
A.Q的熔点比Z的熔点高,Q的硬度比Z的硬度大
B.Z与冷水反应迅速,而Q与冷水几乎不反应
C.Z的最高价氧化物对应水化物是强碱,而Q的最高价氧化物对应水化物具有两性
(3)与Y元素同主族的短周期元素E在自然界中存在多种核素,它们之间的关系互为_______________。
(4)写出Z2M2的电子式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com