
【题目】某新型电池的工作原理如图所示,放电时总反应为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2,下列说法错误的是

A. 放电时,正极的电极反应式为NiO(OH)+e-+H2O=Ni(OH)2+OH-
B. 充电时,阳极的电极反应式为AlO2--3e-+2H2O=A1+4OH-
C. 放电时,Na+向正极移动
D. 充电时,当电路中通过3NA电子时,阳极质量减少3g
科目:高中化学 来源: 题型:
【题目】铬是广泛存在于环境中的金属元素,在水体中主要以三价和六价铬的化合物为主,其中六价铬对人有害。通常含六价铬的酸性工业废水的处理流程为:
![]()
请回答下列问题:
I.(1)第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
a.Cr2O72-和CrO42-的浓度相同 b.2v (Cr2O72-) = v (CrO42-) c.溶液的颜色保持不变
(2)常温下,向100mL、0.1mol/L的K2CrO4溶液加入1mol/L硫酸10mL,存在平衡:
2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O K=5×1014
Cr2O72-(橙色)+H2O K=5×1014
若向上述溶液中加入浓KOH溶液,溶液的颜色由橙色渐变为黄色,反应逆转:Cr2O72-(橙色) +2OH-![]() 2CrO42-(黄色) +H2O
2CrO42-(黄色) +H2O
设该反应的平衡常数为K1,则K1=_______________。
II.为进一步研究初始pH和草酸浓度对第②步反应速率的影响,某学习小组设计对比实验如下表:
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
甲 | 4 | 60 | 10 | 30 |
乙 | 5 | x | 10 | 30 |
丙 | 5 | y | 5 | z |
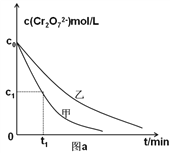
(3)实验设计表中z=_______mL;
(4)实验甲中0~t1时间段反应速率v(Cr3+)=________mol/(L·min) (用含字母的代数式表示)。
(5)常温下,第③步生成的Cr(OH)3在溶液中存在以下平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。
Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是
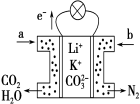
A.a为O2,b为CH4
B.CO 32-向正极移动
C.此电池在常温时也能工作
D.正极电极反应式为2CO2+O2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) △H1
O2(g)=H2O(g) △H1
![]() N2(g)+O2(g)=NO2(g) △H2
N2(g)+O2(g)=NO2(g) △H2
![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) △H3
H2(g)=NH3(g) △H3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的△H为
O2(g)=2NO2(g)+3H2O(g)的△H为
A. 2△H1+2△H2-2△H3 B. △H1+△H2-△H3
C. 3△H1+2△H2+2△H3 D. 3△H1+2△H2-2△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | Q | |
原子半径 | 0.186 | 0.074 | 0.099 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
其他 | 阴离子无核外电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)X和M的原子可构成18电子的分子,该分子的分子式为______________。
(2)Z与Q相比,金属性较强的是______________(用元素符号表示),下列事实能证明一结论的是______________(填字母符号)。
A.Q的熔点比Z的熔点高,Q的硬度比Z的硬度大
B.Z与冷水反应迅速,而Q与冷水几乎不反应
C.Z的最高价氧化物对应水化物是强碱,而Q的最高价氧化物对应水化物具有两性
(3)与Y元素同主族的短周期元素E在自然界中存在多种核素,它们之间的关系互为_______________。
(4)写出Z2M2的电子式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,不正确的是( ) 
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molCl2溶于水后溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA
B. 6.4gCu与足量浓硝酸反应生成NO2分子数目为NA
C. 1mol淀粉(C6H10O5)n水解后产生的葡萄糖分子数目为NA
D. 标准状况下,2molNa2O2与44.8LSO2完全反应,转移的电子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,合成氨反应的热化学方程式为:N2 (g) +3H2 (g)![]() 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
下列叙述正确的是
A. 混合气体的质量不变时,说明该反应一定达到平衡状态
B. 将容器的体积扩大到原来的二倍,υ(正)减小,υ(逆)增大,平衡向左移动
C. 催化剂既能提高N2的转化率,又能缩短达到平衡所需时间,提高生产效益
D. 在密闭容器中放入1 mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CH4催化还原NOX可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJmol-1
已知NO、 NO2混合气体的密度是相同条件下氢气密度的17倍,16g甲烷和该混合气体恰好完全反应生成N2、 CO2、H2O(g)放出1042.8 kJ的热量,则△H1是( )
A.-574kJmol-1 B.-691.2kJmol-1 C.-867kJmol-1 D.-925.6kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com