
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molCl2溶于水后溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA
B. 6.4gCu与足量浓硝酸反应生成NO2分子数目为NA
C. 1mol淀粉(C6H10O5)n水解后产生的葡萄糖分子数目为NA
D. 标准状况下,2molNa2O2与44.8LSO2完全反应,转移的电子数目为4NA
【答案】D
【解析】A,根据Cl守恒,溶液中2n(Cl2)+n(HClO)+n(ClO-)+n(Cl-)=2mol,A项错误;B,n(Cu)=![]() =0.1mol,根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成NO2物质的量为0.2mol,B项错误;C,淀粉水解的方程式为
=0.1mol,根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成NO2物质的量为0.2mol,B项错误;C,淀粉水解的方程式为![]() ,1mol淀粉水解后生成nmol葡萄糖,C项错误;D,n(SO2)=
,1mol淀粉水解后生成nmol葡萄糖,C项错误;D,n(SO2)=![]() =2mol,Na2O2与SO2的反应为Na2O2+SO2=Na2SO4,用单线桥分析反应为:
=2mol,Na2O2与SO2的反应为Na2O2+SO2=Na2SO4,用单线桥分析反应为:![]() ,1molNa2O2与1molSO2反应转移2mol电子,2molNa2O2与2molSO2反应转移4mol电子,D项正确;答案选D。
,1molNa2O2与1molSO2反应转移2mol电子,2molNa2O2与2molSO2反应转移4mol电子,D项正确;答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列是实验操作,能达到实验目的是( )
A. 用25.00mL碱式滴定管量取14.80mLNaOH溶液
B. 用100mL量筒量取5.2mL盐酸
C. 用托盘天平称取25.20g氯化钠
D. 用100mL容量瓶配制50mL0.1mol·L-1盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗铜中一般含有锌、铁、银、金等杂质。在下图所示的装置中,甲池的总反应方程式为2CH3OH+3O2+4KOH=2K2CO3+6H2O。接通电路一段时间后,纯Cu电极质量增加了3.2g。在此过程中,下列说法正确的是
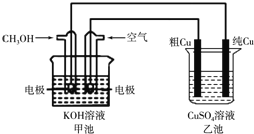
A. 乙池中CuSO4溶液的浓度不变
B. 甲池中理论上消耗标准状况下空气的体积是2.8L(空气中O2体积分数以20%计算)
C. 甲池是电能转化为化学能的装置,乙池是化学能转化为电能的装置
D. 甲池通入CH3OH一极的电极反应为:CH3OH-6e-+2H2O=CO32-+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型电池的工作原理如图所示,放电时总反应为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2,下列说法错误的是

A. 放电时,正极的电极反应式为NiO(OH)+e-+H2O=Ni(OH)2+OH-
B. 充电时,阳极的电极反应式为AlO2--3e-+2H2O=A1+4OH-
C. 放电时,Na+向正极移动
D. 充电时,当电路中通过3NA电子时,阳极质量减少3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物体内构成血红蛋白、叶绿素、甲状腺激素、动物骨骼的重要元素依次是( )
A. I、Mg、Ca、Fe B. Fe、Mg、I、Ca
C. Fe、Ca、I、Mg D. Mg、Fe、I、Ca
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,水的电离达到平衡:H2O![]() H+ + OH-。下列叙述正确的是
H+ + OH-。下列叙述正确的是
A. 将水加热,平衡向正反应方向移动,Kw不变
B. 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大
C. 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低
D. 向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)= c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧.现用下列方法测定该有机化合物的相对分子质量和分子结构. 方法一:用质谱法分析得知A的质谱图如图1: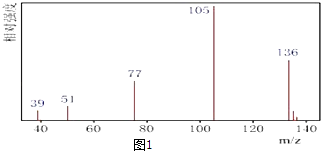
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1:2:2:3.如图2.
方法三:利用红外光谱仪测得A分子的红外光谱,如图3.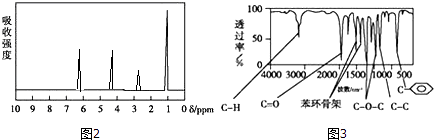
(1)分子中共有种化学环境不同的氢原子.
(2)A的分子式为 .
(3)该物质属于哪一类有机物 .
(4)A的分子中只含一个甲基的依据是(填序号). a.A的相对分子质量 b.A的分子式 c.A的核磁共振氢谱图 d.A分子的红外光谱图
(5)A的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4在工业中有重要应用。用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:
I.向软锰矿浆中通入SO2,锰、铁、铝、铅元素以离子形式浸出,测得浸出液的pH<2。
II.向浸出液中加MnO2,充分反应后,加入石灰乳,调溶液pH = 4.7。
III.再加入阳离子吸附剂,静置后过滤。
IV.滤液蒸发浓缩,冷却结晶,获得MnSO4晶体。
【资料】部分阳离子形成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(1)I中向软锰矿浆中通入SO2生成MnSO4,该反应的化学方程式是________。
(2)II中加入MnO2的主要目的是________;调溶液 pH=4.7,生成的沉淀主要含有________和少量CaSO4。
(3)III中加入阳离子吸附剂,主要除去的离子是________。
(4)用惰性电极电解MnSO4溶液,可以制得高活性MnO2。
①电解MnSO4溶液的离子方程式是________。
②高活性MnO2可用于催化降解甲醛,有关微粒的变化如下图所示,其中X是________,总反应的化学方程式是________。
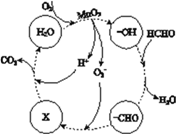
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关生物体细胞组成元素的叙述,错误的是( )
A. 在不同生物的体细胞内,组成它们的化学元素种类大体相同
B. 组成细胞的最基本元素是C
C. 在同一生物的不同体细胞内,各种化学元素的含量相同
D. 组成生物体细胞的化学元素,在无机自然界中都能找到
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com