
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
试回答下列问题:
在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E);
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 2 | 1 | 2 | 3 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
在1L密闭容器中通入10 molCO和10 mol水蒸气,在500℃下经过30s达
到平衡,则30s内CO的平均反应速率为
(3)已知在一定温度下,C(s)+CO2(g)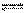 2CO(g)平衡常数K;K的表达式 ;
2CO(g)平衡常数K;K的表达式 ;
C(s)+H2O(g)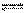 CO(g)+ H2(g)平衡常数K1;
CO(g)+ H2(g)平衡常数K1;
CO(g)+H2O(g)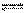 H2(g)+ CO2(g)平衡常数K2;
H2(g)+ CO2(g)平衡常数K2;
则K、K1、K2之间的关系是:
某温度、容积固定容器中,投入一定反应物,对可逆反应
C(s)+ CO2(g)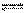 2CO(g)不能判断该反应达到化学平衡状态的是
2CO(g)不能判断该反应达到化学平衡状态的是
A.c(CO2)= c(CO) B.混合气体相对分子质量不变
C.容器中的压强不变 D.v正(CO)= 2v正(CO2) E.c(CO)保持不变
(5)如图1所示,在甲、乙两容器中都充入1mol C和1mol CO2,并使甲、乙
两容器初始容积相等.在相同温度下发生反应C(s)+CO2(g)  2CO(g),
2CO(g),
并维持反应过程中温度不变.已知甲容器中CO2的转化率随时间变化的
图象如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图象.

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多种病毒(如SARS病毒)、细菌、真菌及芽孢。过氧乙酸可由冰醋酸与过氧化氢在一定条件下作用制得,下列有关过氧乙酸的叙述中正确的是
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸与苯酚混合使用,可增强过氧乙酸杀菌效果
C.由下列过氧乙酸的制取原理可以看出,过氧乙酸是酯的同系物
O
||
CH3COOH+H—O—O—H—→CH3—C—O—O—H+H2O
D.浓过氧乙酸溶液中加入少许紫色石蕊试液,振荡后先变红,后褪色。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
B.常温下,2A(s)+B(g)=2C(g)+D(g)不能自发进行,该反应焓变一定大于零
C.1mol硫酸与1molBa(OH)2完全中和所放出的热量为中和热
D.在25℃、101KPa时,2mol S的燃烧热是1mol S的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,可逆反应X(g) + 3Y(g) 2Z(g)达到平衡时,
2Z(g)达到平衡时,
测得Y的转化率为37.5%,X的转化率为25%,则反应开始时,
充入容器中的X、Y的物质的量之比是:
A.13 B.31 C.32 D.12
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量Fe、Fe2O3的混合物中加入250 mL 2 mol·L-1的HNO3溶液,反应完成后生成1.12 L(标准状况)NO气体,再向反应后溶液中加入1 mol·L-1 NaOH溶液,要使铁元素完全沉淀下,所加入NaOH溶液体积最少是( )。
A.450 mL B.500 mL
C.400 mL D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
用3g铁粉与30ml,3mol/L的盐酸反应制取氢气,若要加快产生氢气的速率
可采取措施是( )
A.改用浓H2SO4 B.改用6mol/L的盐酸
C.改用6mol/L的HNO3 D.改用6g的铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
水是人类赖以生存的重要物质,而水污染却严重影响着人类的生存环境。目前,水污染主要
来自: ①工业生产中废渣、废液的任意排放 ②雨水和土壤接触 ③农业生产中农药、化肥
的过量使用 ④城市生活污水的任意排放 ⑤生活垃圾和废旧电池的随意丢弃
A.①②③⑤ B.②③④⑤ C.①③④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置:
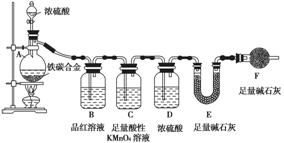
Ⅰ.探究该合金的某些性质:
(1)取a g合金粉末放入蒸馏烧瓶,并加入足量浓硫酸,A、B中均无明显现象,原因是_________________________________________________________________。
(2)点燃酒精灯一段时间后,A中剧烈反应,请写出A中反应的化学方程式:____________________________________________________________________________
________________________________________________________________________。
(3) 在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其分成两份,分别滴加下列溶液,将产生沉淀的化学式填入下表相应的位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
Ⅱ.测定样品中碳的质量分数:
(4)装置F的作用是_______________________________________________________。
(5)反应结束后,若U形管E增重m g,则合金中碳的质量分数为________(用含m和a的式子表示)。若没有装置D,会使合金中碳的质量分数______ (填偏高、偏低、无影响)
(6)若将SO2气体通入含有n mol Na2S的溶液中,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体________mol(不考虑溶解的SO2)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com