
| A. | 氕(${\;}_{1}^{1}$H)和氘(${\;}_{1}^{2}$H) | B. | O2和O3 | ||
| C. | 水和冰 | D. | NO和NO2 |
分析 A.氕(${\;}_{1}^{1}$H)和氘(${\;}_{1}^{2}$H)是同一元素的不同核素;
B.O2和O3都是由氧元素组成的不同单质;
C.水和冰的化学成分相同;
D.NO和NO2不是单质.
解答 解:A.氕(${\;}_{1}^{1}$H)和氘(${\;}_{1}^{2}$H)是氢元素的不同核素,互为同位素,故A错误;
B.O2和O3都是由氧元素组成的不同单质,互为同素异形体,故B正确;
C.水和冰的化学成分相同,是同一种物质,故C错误;
D.NO和NO2不是单质,不是同素异形体,故D错误;
故选B.
点评 本题考查了同素异形体的判断,难度不大,准确掌握同素异形体、同分异构体、同位素、同系物、同一种物质的判断方法是关键.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:解答题

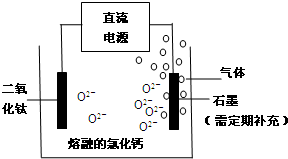
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平行光照射胶体产生丁达尔效应 | B. | 紫外线照射下,液态蛋白质凝固 | ||
| C. | 铁在潮湿的空气中生锈 | D. | 铝遇到冷的浓硝酸溶液发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题: ;反应类型:取代反应
;反应类型:取代反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
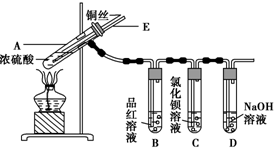
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
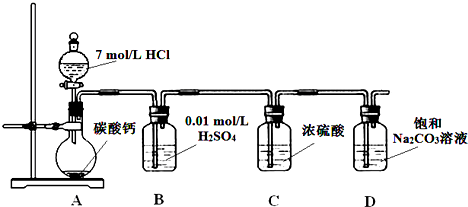
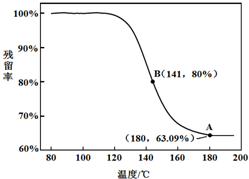
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
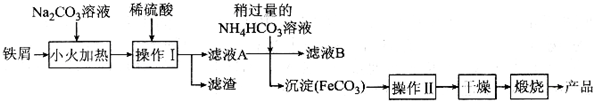
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com