
【题目】有研究预测,到2030年,全球报废的电池将达到1100万吨以上。而目前废旧电池的回收率却很低。为了提高金属资源的利用率,减少环境污染,应该大力倡导回收处理废旧电池。下面是一种从废电池正极材料(含铝箔、LiCoO2、Fe2O3及少量不溶于酸碱的导电剂)中回收各种金属的工艺流程:
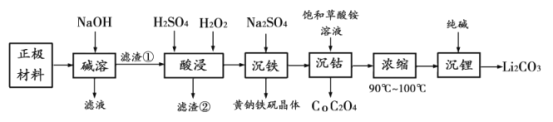
资料:1.黄钠铁矾晶体颗粒粗大,沉淀速度快,易于过滤。
2.钴酸锂难溶于水、碳酸锂的溶解度随温度升高而降低。
回答下列问题:
(1)为了提高碱溶效率可以__,__。(任答两种)
(2)从经济效益的角度考虑,为处理“碱溶”后所得滤液,可向其中通入过量CO2,请写出所发生反应的化学反应方程式__。
(3) “酸浸”时有无色气体产生,写出发生反应的离子方程式__。
(4) “沉铁”时采用的“黄钠铁矾法”与传统的通过调整溶液pH的“氢氧化物沉淀法”相比,金属离子的损失少,请分析并说明原因:___。
(5) “沉锂”后得到碳酸锂固体的实验操作为__。
(6)已知黄钠铁矾的化学式为NaxFey(SO4)m(OH)n。为测定黄钠铁矾的组成,进行了如下实验:①称取4.850g样品,加盐酸完全溶解后,配成100.00mL溶液;②量取25.00mL溶液,加入足量的KI,用0.2500molL-1Na2S2O3溶液进行滴定(反应2Fe3++2I-=2Fe2++I2,I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00mLNa2S2O3溶液至终点。③另取25.00mL溶液,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165g。
用Na2S2O3溶液进行滴定时,使用的指示剂为__;计算出黄钠铁矾的化学式__。
【答案】将正极材料粉碎 搅拌、适当升高温度等(任答两种) Na[Al(OH)4]+CO2==Al(OH)3↓+NaHCO3(或其他合理答案) 2LiCoO2+6H++H2O2==2Li++2Co2++O2↑+4H2O 调节pH时Fe3+会形成Fe(OH)3胶体,吸附溶液中的金属阳离子 趁热过滤 淀粉溶液 NaFe3(SO4)2(OH)6
【解析】
正极材料(含铝箔、LiCoO2、Fe2O3及少量不溶于酸碱的导电剂)加入NaOH碱溶后,铝箔溶解成为滤液,此时滤渣为LiCoO2、Fe2O3及少量不溶于酸碱的导电剂;加入H2SO4、H2O2酸浸后,LiCoO2、Fe2O3溶解生成Li+、Co2+(酸溶时生成的Co3+被H2O2还原为Co2+),不溶于酸碱的导电剂成为滤渣;加入Na2SO4后,Fe3+转化为黄钠铁矾沉淀;加入草酸铵饱和溶液后,Co2+转化为CoC2O4沉淀;溶液浓缩后,加入纯碱,Li+转化为Li2CO3沉淀。
(1)为了提高碱溶效率,可以通过增大接触面积、升高温度等操作实现,具体操作为将正极材料粉碎,搅拌、适当升高温度等(任答两种)。答案为:将正极材料粉碎;搅拌、适当升高温度等(任答两种);
(2)为处理“碱溶”后所得滤液中含有的Na[Al(OH)4],向其中通入过量CO2,生成Al(OH)3沉淀和NaHCO3,发生反应的化学反应方程式为Na[Al(OH)4]+CO2==Al(OH)3↓+NaHCO3。答案为:Na[Al(OH)4]+CO2==Al(OH)3↓+NaHCO3(或其他合理答案);
(3) “酸浸”时,LiCoO2溶解生成Li+、Co2+(酸溶时生成的Co3+被H2O2还原为Co2+),同时生成O2,发生反应的离子方程式为2LiCoO2+6H++H2O2==2Li++2Co2++O2↑+4H2O。答案为:2LiCoO2+6H++H2O2==2Li++2Co2++O2↑+4H2O;
(4) “沉铁”时采用的“黄钠铁矾法”与传统的通过调整溶液pH的“氢氧化物沉淀法”相比,后者生成的Fe(OH)3胶体具有吸附作用,能吸附溶液中的金属离子,从而造成离子损失,原因是:调节pH时Fe3+会形成Fe(OH)3胶体,吸附溶液中的金属阳离子。答案为:调节pH时Fe3+会形成Fe(OH)3胶体,吸附溶液中的金属阳离子;
(5)信息显示,碳酸锂的溶解度随温度升高而降低,由此得出“沉锂”后得到碳酸锂固体的实验操作为趁热过滤。答案为:趁热过滤;
(6)在配成的100.00mL溶液中,依据关系式2Fe3+——I2——2 Na2S2O3,可求出n(Fe3+)=0.2500molL-1×0.030L×4=0.03mol,n(SO42-)=![]() =0.02mol,则
=0.02mol,则
23n(Na+)+17n(OH-)+0.03×56+0.02×96=4.85(质量守恒)
0.03×3+ n(Na+)=0.02×2+ n(OH-) (电荷守恒)
从而求出n(Na+)=0.01mol,n(OH-)=0.06mol,n(Na+):n(Fe3+):n(SO42-):n(OH-)=1:3:2:6,用Na2S2O3溶液进行滴定时,使用的指示剂为淀粉溶液;根据上面计算出的比值,可确定黄钠铁矾的化学式为NaFe3(SO4)2(OH)6。答案为:淀粉溶液;NaFe3(SO4)2(OH)6。


科目:高中化学 来源: 题型:
【题目】下列编号代表元素周期表中的一部分元素,用化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | ⑦ | ⑧ | |||||
三 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
四 | ② | ④ |
(1)①、③、⑤的最高价氧化物的水化物碱性由强到弱顺序为___________(填化学式,下同)。
(2)②、③、④形成的简单阳离子半径由大到小的顺序是______________。
(3)⑨和⑩的最高价氧化物对应的水化物化学式为_______和_________。①在氧气中点燃生成淡黄色的固体,该固体的电子式为_______________,①能够与水剧烈反应,请写出该反应的化学方程式_______________,将元素⑩的单质通入NaBr溶液中,反应的离子方程式为_______________。
(4)⑥、⑦、⑧三种元素形成的气态氢化物的稳定性排序是____________(填化学式,下同),三种元素非金属性由强到弱的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素M、X、Y、Z、W原子序数依次递增,在周期表中M的原子半径最小,X的次外层电子数是其电子总数的![]() ,Y是地壳中含量最高的元素,M与W同主族。下列说法正确的是
,Y是地壳中含量最高的元素,M与W同主族。下列说法正确的是
A.Z的单质与水反应的化学方程式为:Z2+H2O=HZ+HZO
B.X和Z的简单氢化物的稳定性:X<Z
C.X、Y、Z均可与M形成18e-的分子
D.常温下W2XY3的水溶液加水稀释后,所有离子浓度均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某同学进行CO2与Na2O2反应的探究实验,回答下列问题。
(1)用如图装置制备纯净的CO2
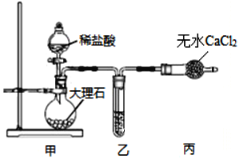
①甲装置中盛放稀盐酸的仪器名称是_____,乙装置中应加入的试剂是_______________。
②装置甲中反应的离子方程式为__________。
(2)按照下面的装置图进行实验(夹持装置略)。
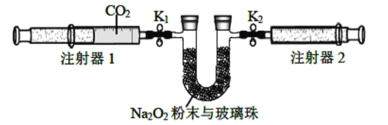
①先组装仪器,然后_______________,再用注射器1抽取100 mL纯净的CO2,将其连接在K1处,注射器2的活塞推到底后连接在K2处,具支U形管中装入足量的Na2O2粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞,可观察到的现象是_______________。
③实验过程中,需缓慢推入CO2,其目的是________________,反应的化学方程式为_______________。
(3)实验结束后,当注射器1的活塞推到底时,测得注射器2中气体体积为65 mL,则反应消耗CO2的体积是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予美国科学家约翰古迪纳夫、斯坦利惠廷厄姆和日本科学家吉野彰,以表彰他们在锂离子电池研发领域作出的贡献。近日,有化学家描绘出了一种使用DMSO(二甲亚砜)作为电解液,并用多孔的黄金作为电极的锂—空气电池的实验模型,该电池放电时在多孔的黄金上氧分子与锂离子反应,形成过氧化锂,其装置图如图所示。下列有关叙述正确的是( )

A.DMSO电解液能传递Li+和电子,不能换成水溶液
B.该电池放电时每消耗2molO2,转移4mol电子
C.给该锂—空气电池充电时,金属锂接电源的正极
D.多孔的黄金为电池正极,电极反应式可能为O2+4e-=2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨对人类生存贡献巨大,反应原理为:N2(g)+3H2(g)![]() 2NH3(g) △H
2NH3(g) △H
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=__。
(2)平衡后,若提高H2的转化率,可以采取的措施有__。
A.加入催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中的部分微粒)。
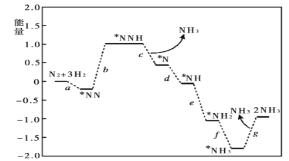
写出步骤c的化学方程式___;由图像可知合成氨反应的△H__0(填“>”“<”或“=”)。
(4)将n(N2)∶n(H2)=1∶3的混合气体,匀速通过装有催化剂的刚性反应器,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图。随着反应器温度升高,NH3的体积分数φ(NH3)先增大后减小的原因是_。
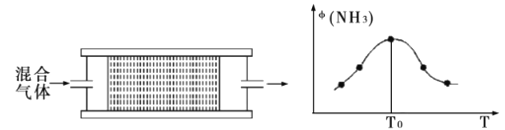
某温度下,混合气体在刚性容器内发生反应,起始气体总压为2×107Pa,平衡时总压为开始的90%,则H2的转化率为___(气体分压P分=P总×体积分数)。用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作KP),此温度下,该反应的化学平衡常数KP=__(分压列计算式、不化简)。
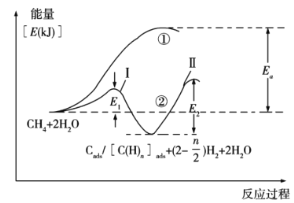
(5)合成氨的原料气H2可来自甲烷水蒸气催化重整(SMR)。我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如CH4→Cads/[C(H)n]ads+(2-![]() )H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/C(H)n]ads+2H2O→CO2+(2+
)H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/C(H)n]ads+2H2O→CO2+(2+![]() )H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①__②(填“>”“<”或“=”);控制整个过程②反应速率的是第__步(填“I”或“II”),其原因为__。
)H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①__②(填“>”“<”或“=”);控制整个过程②反应速率的是第__步(填“I”或“II”),其原因为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.水电离出的c(H+)=10-12mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的水溶液中:NH4+、Al3+、NO3-、Cl-
=1012的水溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池已用于航天飞机,其工作原理如图所示。关于该燃料电池的说法不正确的是
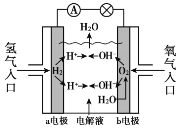
A. H2在负极发生氧化反应
B. 电子从a电极经外电路流向b电极
C. 供电时的总反应为:2H2 + O2 == 2H2O
D. 燃料电池的能量转化率可达100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com