
【题目】下列物质中,属于弱电解质的是
A. 氯化氢B. 氢氧化钠C. 一水合氨D. 铜
科目:高中化学 来源: 题型:
【题目】有机化合物X分子中碳氢质量比为6:1,E的结构简式为(![]() ),请根据下列转化关系图回答问题:
),请根据下列转化关系图回答问题:
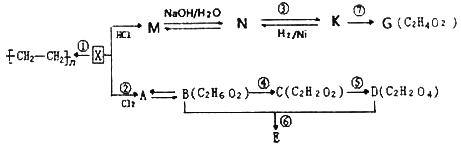
(1)K中官能团的结构式为:__________,C的化学名称是____________。
(2)写出下列反应的反应类型:M→N____________,反应⑤____________________。
(3)写出物质A的结构简式:______________________________________________。
(4)若物质K与银氨溶液反应,化学方程式为__________________________________。
(5)用一种世纪可鉴别N、K、G三种物质,该化学试剂为__________________________。
(6)写出下列反应的化学方程式:
反应⑥_________________________。
(7)与G互为同系物,且比G多3个碳原子的物质的同分异构体个数共有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知通入CH4的一极的电极反应为:CH4+10OH--8e-== CO![]() +7H2O。下列叙述不正确的是
+7H2O。下列叙述不正确的是
A. 通入CH4的电极为负极
B. 正极反应为:2O2+4H2O+8e-===8OH-
C. 燃料电池工作时,溶液中的OH-向正极移动
D. 该电池使用一段时间后溶液中KOH的浓度将不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①甲烷、②乙烷、③乙烯、④苯、⑤甲苯、⑥二甲苯、⑦乙醇、⑧乙酸、
⑨葡萄糖,它们都是常见的重要化工原料。
(1)上述物质中,氢元素的质量分数最大的是________(填分子式),等质量的物质完全燃烧耗氧量相同的是_____________________(填分子式)。
(2)上述物质中,能发生加成反应的烃类物质有:_______________(填序号)。
(3)甲烷和苯都可以发生取代反应,反应条件分别是___________、___________。
(4)聚氯乙烯,简称PVC,这种材料如果用于食品包装,它对人体的安全性有一定的影响,PVC由Cl—CH=CH2在一定条件下聚合而成,写出该反应的化学方程式:____________。
(5)苯、甲苯、二甲苯是用途广泛的有机溶剂。二甲苯的结构有______种,其中一种被称为“PX”,它的一氯代物只有两种,则“PX”的结构简式是______________。
(6)写出乙醇催化氧化的化学方程式 _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳呼吸电池”是一种新型能源装置,其工作原理如下图。下列说法正确的是

A. 该装置是将电能转变为化学能
B. 利用该技术可捕捉大气中的CO2
C. 每得到1mol草酸铝,电路中转移3mol电子
D. 正极的电极反应为:C2O42--2e-=2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学进行了FeCl2溶液的配制、浓度的测定以及Fe2+还原性的实验,并针对异常现象进行探究。
步骤一:制取FeCl2甲同学准备用两种方案制取。
方案1:按下图装置用H2还原无水FeCl3制取。
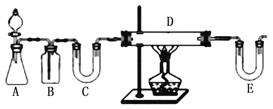
E中盛放的试剂是____________;D中反应的化学方程式为____________。此方案有个明显的缺陷是___________________________。
方案2:由0.1 molL-1 FeCl3溶液制取FeCl2溶液,你认为其操作应该是____________ 。
步骤二:测定方案2所配FeCl2溶液的物质的量浓度。用重铬酸钾法(一种氧化还原滴定法)可达到目的。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液480 mL,实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少_______________,
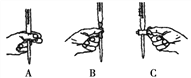
本实验滴定过程中操作滴定管的图示正确的是____________(填编号)。
下列错误的操作使测定的FeCl2 溶液浓度偏小的是______________。
A.若在配制K2Cr2O7标准溶液定容时采取俯视姿势
B.若滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失。
C.锥形瓶洗净后未干燥
步骤三:向2 mL FeCl2溶液中滴加2滴0.1 mol·L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol·L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
甲同学探究“步骤三”中溶液褪色的原因:
实验I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
实验II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀,并测得生成了两种可直接排放到空气中的气体。
实验III.向2 mL 0.1 mol·L-1 FeCl3溶液中滴加2滴0.1 molL-1 KSCN溶液,变红,通入O2,无明显变化。
①实验I说明溶液红色褪去是因为SCN-发生了反应而不是Fe3+发生反应。
②实验III的目的是_____________________。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-和相关气体。写出该反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由SiO2、Fe2O3、Fe、Na2SO3、Na2CO3、BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如下图所示:
下列说法正确的是

A. 气体A是SO2和CO2的混合气体
B. 固体A一定含有SiO2,可能含有BaSO4
C. 该固体混合物中Fe2O3和Fe至少有其中一种
D. 该固体混合物一定含有Fe、Na2SO3、BaCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com