
【题目】甲同学进行了FeCl2溶液的配制、浓度的测定以及Fe2+还原性的实验,并针对异常现象进行探究。
步骤一:制取FeCl2甲同学准备用两种方案制取。
方案1:按下图装置用H2还原无水FeCl3制取。
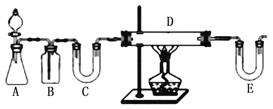
E中盛放的试剂是____________;D中反应的化学方程式为____________。此方案有个明显的缺陷是___________________________。
方案2:由0.1 molL-1 FeCl3溶液制取FeCl2溶液,你认为其操作应该是____________ 。
步骤二:测定方案2所配FeCl2溶液的物质的量浓度。用重铬酸钾法(一种氧化还原滴定法)可达到目的。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液480 mL,实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少_______________,
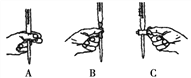
本实验滴定过程中操作滴定管的图示正确的是____________(填编号)。
下列错误的操作使测定的FeCl2 溶液浓度偏小的是______________。
A.若在配制K2Cr2O7标准溶液定容时采取俯视姿势
B.若滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失。
C.锥形瓶洗净后未干燥
步骤三:向2 mL FeCl2溶液中滴加2滴0.1 mol·L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol·L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
甲同学探究“步骤三”中溶液褪色的原因:
实验I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
实验II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀,并测得生成了两种可直接排放到空气中的气体。
实验III.向2 mL 0.1 mol·L-1 FeCl3溶液中滴加2滴0.1 molL-1 KSCN溶液,变红,通入O2,无明显变化。
①实验I说明溶液红色褪去是因为SCN-发生了反应而不是Fe3+发生反应。
②实验III的目的是_____________________。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-和相关气体。写出该反应的离子方程式_______________________。
【答案】 碱石灰(NaOH或CaO或其它碱性固体干燥剂) H2+2FeCl3=2FeCl2+2HCl 没有处理尾气H2 向0.1 mol·L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液。 500 mL容量瓶、胶头滴管 A A 排除H2O2分解产生的O2氧化SCN-的可能。 2SCN—+ 11H2O2 == 2SO42-+ 2H++2 CO2 ↑+ N2↑+10 H2O
【解析】步骤一:方案1:按如图中装置可知,用H2还原无水FeCl3制取无水FeCl2,A装置一般用锌和稀盐酸制备H2,B装置用来除去氢气中的氯化氢,C装置用来干燥氢气,可以装置碱石灰,E装置中也要装置碱石灰,吸收氯化氢气体同时防止空气中的水份进入D装置,D装置中用氢气与氯化铁反应生成氯化亚铁,所以E中盛放的试剂是 碱石灰,D中反应的化学方程式为 H2+2FeCl3=2FeCl2+2HCl,根据装置图可知,此方案有个明显的缺陷是没有处理尾气H2;
方案2:由FeCl3溶液制取FeCl2溶液,可以在氯化铁溶液中加入足量铁粉,其操作为向0.1 molL-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液;
步骤二:根据配制一定物质的量浓度溶液的操作步骤可知,配制溶液是需要500 mL容量瓶、胶头滴管、量筒、玻璃棒、烧杯等,在操作滴定管时应用左手握住活塞,手指在另上侧拧开活塞,故选 A;在氧化还原滴定中:A.若在配制K2Cr2O7标准溶液定容时采取俯视姿势,会使标准液的浓度偏高,导致消耗的标准液的体积偏小,会使测定的FeCl2溶液浓度偏小,正确;B.若滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,使标准液的体积偏大,会使测定的FeCl2溶液浓度偏大,B错误;C.锥形瓶洗净后未干燥,对实验没有影响,C错误,答案选A;
步骤三:根据实验步骤可知,实验III的目的是排除H2O2分解产生的O2氧化SCN-的可能,在酸性条件下H2O2将SCN-氧化成SO42-和氮气,同时有二氧化碳生成,反应的离子方程式为2SCN-+ 11H2O2=2SO42-+ 2H++2 CO2 ↑+ N2↑+10 H2O。


科目:高中化学 来源: 题型:
【题目】铁、钴、镍等单质及化合物的应用广泛。
(1)LiFePO4是锂离子电池材料,画出Fe2+的价层电子排布图____________,其中PO43-的立体构型是____________。
(2)化合物“钴酞菁”能显著提升二次电池的充放电效率,下图是改性“氨基钴酞菁”分子的结构图。
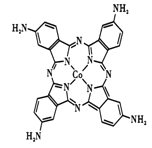
①写出氨基钴酞菁中N 原子的杂化轨道类型____________;
②写出一种与氨基阴离子NH2-互为等电子体的中性分子____________;
③将“钴酞菁”改性为“氨基钴酞菁”后,能使其水溶性得到有效改善,请简述其原因:____________
(3)1mol[Co(NO2)6]3-中所含的σ键数目是____________。K3[Co(NO2)6]中四种元素的第一电离能由大到小的顺序是____________。
如图所示为NiO晶体的晶胞结构示意图:
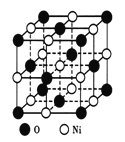
①该晶胞中占有阴阳离子总数是____________;
②己知在NiO晶体中Ni2+的半径为a pm,O2-的半径为bpm,它们在晶体中是紧密接触的,则在NiO晶体中原子的空间利用率为____________。(用含字母a、b的计算式表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,在试管a中先加入2mL95%的乙醇,边摇动边缓缓加入5mL浓H2SO4并充分摇匀,冷却后再加入2 mL醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液。连接好装置,用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。

(1)写出a试管中的主要化学反应的方程式___________________;
(2)加入浓H2SO4的目的是_____________________。
(3)试管b中观察到的现象是__________,__________。
(4)在实验中球形干燥管除起冷凝作用外,另一个重要作用_______________。
(5)饱和Na2CO3溶液的作用是 ________ 、 _________ 、 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数一定相同的是(NA表示阿伏加德罗常数)
A. 1molH2和16gO2 B. NA个N2和11gCO2
C. 18gH2O和1mol Br2 D. 22.4LH2和NA个CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合径中乙炔的体积分数为( )
A.12.5% B.25% C.50% D.75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法错误的是
A. 1 LpH=1 Ba(OH)2溶液中所含OH-的数目为0.2NA
B. 28g聚乙烯![]() 中含有的碳原子数为2NA
中含有的碳原子数为2NA
C. 1 mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-的数目为NA
D. 1 mol Na与O2完全反应生成Na2O和Na2O2的混合物,转移的电子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1的HR溶液中逐渐滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电能力变化如图。下列分析不正确的是

A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=7,此时酸碱恰好中和
C. b、c两点水的电离程度:b<c
D. c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为倡导“低碳”,减小CO2对环境的影响,需对CO2进行创新利用研究。T1℃使,将将9 mol CO2和12 mol H2充入3 L密闭容器中,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p0。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是
CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p0。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是
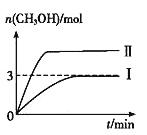
A. 曲线Ⅱ对应的条件改变是增大压强
B. T2℃时,上述反应平衡常数为0.52,则T2>T1
C. 在T1℃,若起始时向容器充入4.5 mol CO2、6 mol H2,平衡时容器内压强P1>P0/2
D. 在T1℃,若起始时向容器中充入4.5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com