
【题目】如下图,在试管a中先加入2mL95%的乙醇,边摇动边缓缓加入5mL浓H2SO4并充分摇匀,冷却后再加入2 mL醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液。连接好装置,用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。

(1)写出a试管中的主要化学反应的方程式___________________;
(2)加入浓H2SO4的目的是_____________________。
(3)试管b中观察到的现象是__________,__________。
(4)在实验中球形干燥管除起冷凝作用外,另一个重要作用_______________。
(5)饱和Na2CO3溶液的作用是 ________ 、 _________ 、 _______。
【答案】 CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O 催化剂 有气泡 液体分层 防止倒吸 溶解乙醇 吸收醋酸 降低乙酸乙酯的溶解度
CH3COOCH2CH3+H2O 催化剂 有气泡 液体分层 防止倒吸 溶解乙醇 吸收醋酸 降低乙酸乙酯的溶解度
【解析】(1)装置中发生的反应是利用醋酸钠和浓硫酸反应生成醋酸和乙醇在浓硫酸催化作用下发生酯化反应,生成乙酸乙酯和水,反应的化学方程式为:
2CH3COONa+H2SO4=2CH3COOH+Na2SO4 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(2)用酸性和醋酸钠制乙酸,浓硫酸有吸水性,促进该反应向正反应方向移动,浓硫酸能加快反应速率,所以浓硫酸作酸、催化剂和吸水剂;
(3)试管b饱和碳酸钠溶液中,生成的乙酸乙酯在水溶液上层,试管中观察到的现象是:溶液分层,在饱和碳酸钠上层产生有特殊香味的无色液体;
(4)乙酸乙酯中混有乙醇和乙酸,二者易溶于水而产生倒吸,球形漏斗由于容积较大,能起到防止倒吸的作用;
(5)碳酸钠溶液中的水溶解乙醇,能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,降低乙酸乙酯的溶解度,使乙酸乙酯难溶于饱和碳酸钠溶液,便于分层。


科目:高中化学 来源: 题型:
【题目】在2NO2![]() N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
A. N2O4和NO2的分子数比为1:2
B. N2O4和NO2的浓度相等
C. 体系的颜色不再改变
D. 单位时间内有1molN2O4转化为NO2的同时,有2molNO2转化为N2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①甲烷、②乙烷、③乙烯、④苯、⑤甲苯、⑥二甲苯、⑦乙醇、⑧乙酸、
⑨葡萄糖,它们都是常见的重要化工原料。
(1)上述物质中,氢元素的质量分数最大的是________(填分子式),等质量的物质完全燃烧耗氧量相同的是_____________________(填分子式)。
(2)上述物质中,能发生加成反应的烃类物质有:_______________(填序号)。
(3)甲烷和苯都可以发生取代反应,反应条件分别是___________、___________。
(4)聚氯乙烯,简称PVC,这种材料如果用于食品包装,它对人体的安全性有一定的影响,PVC由Cl—CH=CH2在一定条件下聚合而成,写出该反应的化学方程式:____________。
(5)苯、甲苯、二甲苯是用途广泛的有机溶剂。二甲苯的结构有______种,其中一种被称为“PX”,它的一氯代物只有两种,则“PX”的结构简式是______________。
(6)写出乙醇催化氧化的化学方程式 _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳呼吸电池”是一种新型能源装置,其工作原理如下图。下列说法正确的是

A. 该装置是将电能转变为化学能
B. 利用该技术可捕捉大气中的CO2
C. 每得到1mol草酸铝,电路中转移3mol电子
D. 正极的电极反应为:C2O42--2e-=2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下一系列反应,最终产物是乙二酸.
CH3CH3 ![]() A
A![]() B
B![]() C
C![]() D
D![]() E
E![]() 乙二酸(HOOC—COOH)
乙二酸(HOOC—COOH)
(1)B的结构简式是____________,A―→B的反应类型是____________,
(2)C→D的化学方程式是____________________________________________________,
(3)E与银氨溶液发生反应的化学方程式是
_____________________________________________,
(4)1 mol乙二酸与1molD恰好完全反应生成的环状化合物的名称是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学进行了FeCl2溶液的配制、浓度的测定以及Fe2+还原性的实验,并针对异常现象进行探究。
步骤一:制取FeCl2甲同学准备用两种方案制取。
方案1:按下图装置用H2还原无水FeCl3制取。
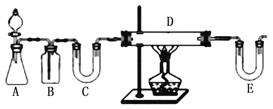
E中盛放的试剂是____________;D中反应的化学方程式为____________。此方案有个明显的缺陷是___________________________。
方案2:由0.1 molL-1 FeCl3溶液制取FeCl2溶液,你认为其操作应该是____________ 。
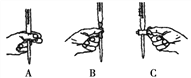
步骤二:测定方案2所配FeCl2溶液的物质的量浓度。用重铬酸钾法(一种氧化还原滴定法)可达到目的。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液480 mL,实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少_______________,
本实验滴定过程中操作滴定管的图示正确的是____________(填编号)。
下列错误的操作使测定的FeCl2 溶液浓度偏小的是______________。
A.若在配制K2Cr2O7标准溶液定容时采取俯视姿势
B.若滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失。
C.锥形瓶洗净后未干燥
步骤三:向2 mL FeCl2溶液中滴加2滴0.1 mol·L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol·L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
甲同学探究“步骤三”中溶液褪色的原因:
实验I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
实验II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀,并测得生成了两种可直接排放到空气中的气体。
实验III.向2 mL 0.1 mol·L-1 FeCl3溶液中滴加2滴0.1 molL-1 KSCN溶液,变红,通入O2,无明显变化。
①实验I说明溶液红色褪去是因为SCN-发生了反应而不是Fe3+发生反应。
②实验III的目的是_____________________。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-和相关气体。写出该反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3俗名纯碱,下面是对纯碱采用不同的分类法进行分类,其中正确的是
A.Na2CO3是碱 B.Na2CO3是盐
C.Na2CO3是钠盐 D.Na2CO3是碳酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有①![]() 、
、![]() 、
、![]() ②H2、D2、T2 ③石墨、金刚石 ④
②H2、D2、T2 ③石墨、金刚石 ④![]() 、
、![]() 、
、![]() 四组微粒或物质。互为同位素的是__________________(填编号)。
四组微粒或物质。互为同位素的是__________________(填编号)。
(2)下列物质中:①N2 ②MgCl2 ③NH4Cl ④CH4 ⑤CO2 ⑥Ne ⑦H2S ⑧KOH ⑨Na2O2 ⑩K2O 只存在共价键的是___________;属于离子化合物,但含有共价键的是______。
(3) 用电子式表示下列物质:
MgCl2___________N2___________NH4+___________Na2O2___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com