
����Ŀ�������ܡ����ȵ��ʼ��������Ӧ�ù㷺��
��1��LiFePO4������ӵ�ز��ϣ�����Fe2+�ļ۲�����Ų�ͼ____________������PO43-�����幹����____________��
��2���������̪ݼ���������������ε�صij�ŵ�Ч�ʣ���ͼ�Ǹ��ԡ�������̪ݼ�����ӵĽṹͼ��
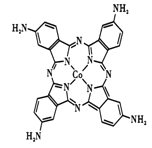
��д��������̪ݼ��N ԭ�ӵ��ӻ��������____________��
��д��һ���백��������NH2-��Ϊ�ȵ���������Է���____________��
�۽�����̪ݼ������Ϊ��������̪ݼ������ʹ��ˮ���Եõ���Ч���ƣ��������ԭ��____________
��3��1mol[Co(NO2)6]3-�������ĦҼ���Ŀ��____________��K3[Co(NO2)6]������Ԫ�صĵ�һ�������ɴ�С��˳����____________��
��ͼ��ʾΪNiO����ľ����ṹʾ��ͼ:
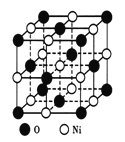
�ٸþ�����ռ����������������____________��
�ڼ�֪��NiO������Ni2+�İ뾶Ϊa pm��O2-�İ뾶Ϊbpm�������ھ������ǽ��ܽӴ��ģ�����NiO������ԭ�ӵĿռ�������Ϊ____________�����ú���ĸa��b�ļ���ʽ���
���𰸡�  �������� sp2��sp3 H2O��H2S�� ����İ����ϵ�Hԭ�ӿ���ˮ�����γ���� 18NA N>O>Co>K 8
�������� sp2��sp3 H2O��H2S�� ����İ����ϵ�Hԭ�ӿ���ˮ�����γ���� 18NA N>O>Co>K 8 ![]() ��
��![]() ��100%
��100%
����������1������ԭ��������26����Fe2+�ļ۲�����Ų�ͼΪ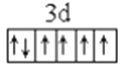 ������PO43-��P�ļ۲���Ӷ�����4���Ҳ����ڹ¶Ե��ӣ��������幹�����������塣��2���ٰ�����̪ݼ��N ԭ�Ӽ����γ�˫����Ҳ���γɵ��������ӻ��������Ϊsp2��sp3����ԭ�����ͼ۵������ֱ���ȵ��ǵȵ����壬��������NH2-��Ϊ�ȵ���������Է���Ϊ H2O��H2S�ȣ��۽�����̪ݼ������Ϊ��������̪ݼ������������İ����ϵ�Hԭ�ӿ���ˮ�����γ������������ʹ��ˮ���Եõ���Ч���ƣ���3���������ǦҼ���˫���к���1���Ҽ�����1mol[Co(NO2)6]3-�������ĦҼ���Ŀ�� 18NA���ǽ�����Խǿ����һ������Խ��Ԫ�ص�2p������Ӵ��ڰ����״̬���ȶ���ǿ����K3[Co(NO2)6]������Ԫ�صĵ�һ�������ɴ�С��˳����N>O>Co>K����4���ٸþ����������Ӹ�����8��1/8+6��1/2=4�������Ӹ�����12��1/4+1=4�����ռ����������������8���ھ����й�����4��Ni2+��4��O2�������Ϊ��
������PO43-��P�ļ۲���Ӷ�����4���Ҳ����ڹ¶Ե��ӣ��������幹�����������塣��2���ٰ�����̪ݼ��N ԭ�Ӽ����γ�˫����Ҳ���γɵ��������ӻ��������Ϊsp2��sp3����ԭ�����ͼ۵������ֱ���ȵ��ǵȵ����壬��������NH2-��Ϊ�ȵ���������Է���Ϊ H2O��H2S�ȣ��۽�����̪ݼ������Ϊ��������̪ݼ������������İ����ϵ�Hԭ�ӿ���ˮ�����γ������������ʹ��ˮ���Եõ���Ч���ƣ���3���������ǦҼ���˫���к���1���Ҽ�����1mol[Co(NO2)6]3-�������ĦҼ���Ŀ�� 18NA���ǽ�����Խǿ����һ������Խ��Ԫ�ص�2p������Ӵ��ڰ����״̬���ȶ���ǿ����K3[Co(NO2)6]������Ԫ�صĵ�һ�������ɴ�С��˳����N>O>Co>K����4���ٸþ����������Ӹ�����8��1/8+6��1/2=4�������Ӹ�����12��1/4+1=4�����ռ����������������8���ھ����й�����4��Ni2+��4��O2�������Ϊ��![]() �������ı߳�Ϊ2a+2b���������Ϊ��2a+2b��3���Ȼ��ƾ��������ӵĿռ�������Ϊ
�������ı߳�Ϊ2a+2b���������Ϊ��2a+2b��3���Ȼ��ƾ��������ӵĿռ�������Ϊ![]() ��100%
��100%



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ç������һ�ֺϳ�ҩ���Ƶ�ԭ�ϣ����������ƻ������ʯ���ֲ���С����й����������л��������˵����ȷ����
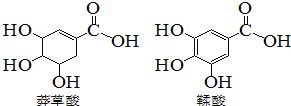
A. ç�������ʽΪC7H10O5
B. �����ᶼ������ˮ�����ӳɷ�Ӧ
C. ���������ç������ӻ�Ϊͬϵ��
D. �����ʵ������������������������Ʒ�Ӧ�������������Ƶ����ʵ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������X������̼��������Ϊ6:1��E�Ľṹ��ʽΪ��![]() �������������ת����ϵͼ�ش����⣺
�������������ת����ϵͼ�ش����⣺
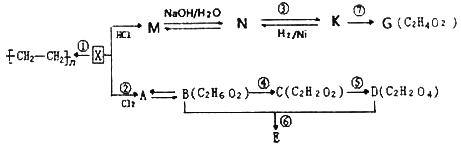
��1��K�й����ŵĽṹʽΪ��__________��C�Ļ�ѧ������____________��
��2��д�����з�Ӧ�ķ�Ӧ���ͣ�M��N____________����Ӧ��____________________��
��3��д������A�Ľṹ��ʽ��______________________________________________��
��4��������K��������Һ��Ӧ����ѧ����ʽΪ__________________________________��
��5����һ�����Ϳɼ���N��K��G�������ʣ��û�ѧ�Լ�Ϊ__________________________��
��6��д�����з�Ӧ�Ļ�ѧ����ʽ��
��Ӧ��_________________________��
��7����G��Ϊͬϵ��ұ�G��3��̼ԭ�ӵ����ʵ�ͬ���칹���������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2NO2![]() N2O4�Ŀ��淴Ӧ�У�����״̬һ������ƽ��״̬���ǣ� ��
N2O4�Ŀ��淴Ӧ�У�����״̬һ������ƽ��״̬���ǣ� ��
A. N2O4��NO2�ķ�������Ϊ1��2
B. N2O4��NO2��Ũ�����
C. ��ϵ����ɫ���ٸı�
D. ��λʱ������1molN2O4ת��ΪNO2��ͬʱ����2molNO2ת��ΪN2O4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Т�MgSO4����Ba(NO3)2����NaOH����CuCl2������Һ�����������Լ��Ϳɼ��������������Ⱥ�˳����(����)
A. �ܢۢ٢� B. �ۢܢ٢� C. �ڢ٢ۢ� D. �ۢܢڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����һ���������ォ��ˮ�е�����(H2NCONH2����Ԫ����-3��)�Ļ�ѧ��ֱ��ת��Ϊ���ܣ������ɶԻ��������ʵ�װ�ã�ͬʱ���ô�װ�õĵ��������϶�ͭ������˵���в���ȷ����( )
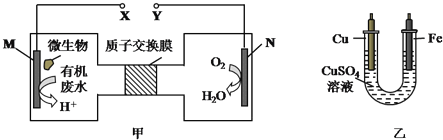
A��H+�����ӽ���Ĥ���������ƶ�
B��ͭ�缫Ӧ��Y������
C��M�缫��Ӧʽ��H2NCONH2+H2O-6e-�TCO2��+N2��+6H+
D����N�缫����0.25mol����ʱ�������缫����16g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������缫����KOH��Һ�У��������ֱ�ͨ��CH4��O2�����ɼ���ȼ�ϵ�ء���֪ͨ��CH4��һ���ĵ缫��ӦΪ��CH4��10OH����8e��== CO![]() ��7H2O��������������ȷ����
��7H2O��������������ȷ����
A. ͨ��CH4�ĵ缫Ϊ����
B. ������ӦΪ��2O2��4H2O��8e��===8OH��
C. ȼ�ϵ�ع���ʱ����Һ�е�OH���������ƶ�
D. �õ��ʹ��һ��ʱ�����Һ��KOH��Ũ�Ƚ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ټ��顢�����顢����ϩ���ܱ����ݼױ������ױ������Ҵ��������ᡢ
�������ǣ����Ƕ��dz�������Ҫ����ԭ�ϡ�
��1�����������У���Ԫ�ص���������������________�������ʽ������������������ȫȼ�պ�������ͬ����_____________________�������ʽ����
��2�����������У��ܷ����ӳɷ�Ӧ�����������У�_______________������ţ���
��3������ͱ������Է���ȡ����Ӧ����Ӧ�����ֱ���___________��___________��
��4��������ϩ�����PVC�����ֲ����������ʳƷ��װ����������İ�ȫ����һ����Ӱ�죬PVC��Cl��CH��CH2��һ�������¾ۺ϶��ɣ�д���÷�Ӧ�Ļ�ѧ����ʽ��____________��
��5�������ױ������ױ�����;�㷺���л��ܼ������ױ��Ľṹ��______�֣�����һ�ֱ���Ϊ��PX��������һ�ȴ���ֻ�����֣���PX���Ľṹ��ʽ��______________��
��6��д���Ҵ��������Ļ�ѧ����ʽ _________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬѧ������FeCl2��Һ�����ơ�Ũ�ȵIJⶨ�Լ�Fe2+��ԭ�Ե�ʵ�飬������쳣�������̽����
����һ����ȡFeCl2��ͬѧ�������ַ�����ȡ��
����1������ͼװ����H2��ԭ��ˮFeCl3��ȡ��
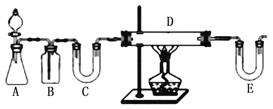
E��ʢ�ŵ��Լ���____________��D�з�Ӧ�Ļ�ѧ����ʽΪ____________���˷����и����Ե�ȱ����___________________________��
����2����0.1 molL-1 FeCl3��Һ��ȡFeCl2��Һ������Ϊ�����Ӧ����____________ ��
��������ⶨ����2����FeCl2��Һ�����ʵ���Ũ�ȡ����ظ���ط���һ��������ԭ�ζ������ɴﵽĿ�ġ���������Ũ��Ϊ0.01000 mol��L��1��K2Cr2O7����Һ480 mL��ʵ�����õ��IJ�����������Ͳ�����������ձ�����ȱ��_______________��
��ʵ��ζ������в����ζ��ܵ�ͼʾ��ȷ����____________(����)��
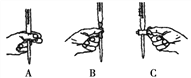
���д���IJ���ʹ�ⶨ��FeCl2 ��ҺŨ��ƫС����______________��
A����������K2Cr2O7����Һ����ʱ��ȡ��������
B�����ζ������У�����ζ�ǰװ��K2Cr2O7����Һ�ĵζ��ܼ��첿�������ݣ����ζ�������������ʧ��
C����ƿϴ����δ����
����������2 mL FeCl2��Һ�еμ�2��0.1 mol��L-1 KSCN��Һ���������ٵμ�5��5% H2O2��Һ�����ʵ���Ũ��ԼΪ1.5 mol��L-1��pHԼΪ5�����۲쵽��Һ��죬��Լ10�����Һ�ɫ��ȥ�����������ɣ�������ΪO2����
��ͬѧ̽����������������Һ��ɫ��ԭ��
ʵ��I��ȡ��ɫ����Һ���ݣ�һ�ݵμ�FeCl3��Һ��������һ�ݵμ�KSCN��Һ���ֺ�ɫ��
ʵ��II��ȡ��ɫ����Һ���μ������BaCl2��Һ��������ɫ��������������������ֿ�ֱ���ŷŵ������е����塣
ʵ��III����2 mL 0.1 mol��L-1 FeCl3��Һ�еμ�2��0.1 molL-1 KSCN��Һ����죬ͨ��O2�������Ա仯��
��ʵ��I˵����Һ��ɫ��ȥ����ΪSCN�������˷�Ӧ������Fe3��������Ӧ��
��ʵ��III��Ŀ����_____________________��
�ó����ۣ���Һ��ɫ��ԭ��������������H2O2��SCN-������SO42����������塣д���÷�Ӧ�����ӷ���ʽ_______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com