
【题目】现有①MgSO4 ②Ba(NO3)2 ③NaOH ④CuCl2四种溶液,不加其他试剂就可鉴别出来,鉴别的先后顺序是( )
A. ④③①② B. ③④①② C. ②①③④ D. ③④②①
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL 0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.2000mol·L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是

A. 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+)
B. 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C. 点c所示溶液中:c(SO42-)+c(H+)=c(NH3H2O)+c(OH-)
D. 点d所示溶液中:c(SO42-)>c(NH3H2O)>c(NH4+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 氯气可用于药物的合成
B. 钠和钾合金在常温下是液体,可用于快中子反应堆作热交换剂
C. 硫酸铜可用于饮用水消毒
D. 生物质能来源于植物及其加工产品所贮存的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用反应3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性
C.生成1 mol N2有3 mol 电子转移 D.该反应不属于复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气脱除SO2及NOx对解决雾霾污染很重要,脱硫脱硝的方法很多,一种ClO2气相氧化法反应机理和速率常数(K)如下:
脱硝:①NO(g)+ ClO2(g)= NO2(g)+ ClO(g) △H1 k1=l.7×1011mL·(mol·s)-1
②NO(g)+ ClO(g)= NO2(g)+Cl(g) △H2 k2=8.8×1012 mL·(mol·s)-1
脱硫:③SO2(g)+ClO2(g)=SO3(g)+ClO(g) △H3 k3=2.1×10-4 mL·(mol·s)-1
④SO2(g)+ClO(g)=SO3(g)+ Cl(g) △H 4 k4=6.9×1011 mL·(mol·s)-1
两过程中产生的Cl可与ClO2进一步反应,如:
⑤C1(g)+ClO2(g)=2ClO(g) △H5
(1)同时脱硫脱硝反应NO(g)+SO2(g)+2ClO2(g)=NO2(g)+SO3(g)+ 2ClO(g)的反应热最简表达式△H=____________。
(2)己知反应③④的速率方程分別为v正=k3·c (SO2) · c (ClO2)、v正=k4·c (SO2) · c (ClO),试判断两反应的活化能大小,E3____________E4(填“>”“<”或“=”)。控制脱硫速度的关键步骤是____________反应(填③或④)
(3)SO2、NO单独氧化及同时氧化对两气体氧化率变化如图,同时氧化对____________气体的氧化率影响明显,结合①③④反应及其速率常数分析原因____________。

(4)气相中水蒸气含量提高,SO2单独氧化率会迅速提升,并生成两种常见的酸,请写出该过程化学反应方程式__________________________________。
(5)“湿式吸收法”利用吸收剂与SO2发生反应从而达脱硫目的。
①下列适合作该法吸收剂的是____________(填序号)。
A.氨水 B. Na2SO4溶液 C. Na2CO3 溶液D. NaHSO4溶液
②用石灰水也可吸收SO2,生成亚硫酸钙浊液。
计算 CaSO3(s)+H+(aq)![]() Ca2+(aq)+HSO3-(aq)的平衡常数K=____________。25℃时,H2SO3电离常数为:K1=1.41×10-2,K2=6.30×10-8 Ksp=6.76×10-3
Ca2+(aq)+HSO3-(aq)的平衡常数K=____________。25℃时,H2SO3电离常数为:K1=1.41×10-2,K2=6.30×10-8 Ksp=6.76×10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍等单质及化合物的应用广泛。
(1)LiFePO4是锂离子电池材料,画出Fe2+的价层电子排布图____________,其中PO43-的立体构型是____________。
(2)化合物“钴酞菁”能显著提升二次电池的充放电效率,下图是改性“氨基钴酞菁”分子的结构图。
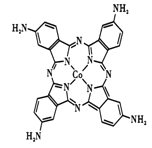
①写出氨基钴酞菁中N 原子的杂化轨道类型____________;
②写出一种与氨基阴离子NH2-互为等电子体的中性分子____________;
③将“钴酞菁”改性为“氨基钴酞菁”后,能使其水溶性得到有效改善,请简述其原因:____________
(3)1mol[Co(NO2)6]3-中所含的σ键数目是____________。K3[Co(NO2)6]中四种元素的第一电离能由大到小的顺序是____________。
如图所示为NiO晶体的晶胞结构示意图:
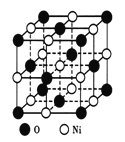
①该晶胞中占有阴阳离子总数是____________;
②己知在NiO晶体中Ni2+的半径为a pm,O2-的半径为bpm,它们在晶体中是紧密接触的,则在NiO晶体中原子的空间利用率为____________。(用含字母a、b的计算式表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用浓度为0.100 0 mol·L-1的氢氧化钠溶液分别滴定20.00 mL浓度均为0.100 0 mol·L-1的二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断不正确的是 ( )
数据编号 | 滴入NaOH(aq) 的体积/mL | 溶液的pH | |
HX | HY | ||
① | 0 | 3 | 1 |
② | a | 7 | x |
③ | 20.00 | >7 | y |
A. 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY
B. 由表中数据可估算出Ka(HX)≈10-5
C. HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-)
D. 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从香荚兰豆中提取的一种芳香化合物,其分子式为C8H8O3,遇FeCl3溶液会呈现特征颜色,能发生银镜反应。该化合物可能的结构简式是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数一定相同的是(NA表示阿伏加德罗常数)
A. 1molH2和16gO2 B. NA个N2和11gCO2
C. 18gH2O和1mol Br2 D. 22.4LH2和NA个CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com