
【题目】燃煤烟气脱除SO2及NOx对解决雾霾污染很重要,脱硫脱硝的方法很多,一种ClO2气相氧化法反应机理和速率常数(K)如下:
脱硝:①NO(g)+ ClO2(g)= NO2(g)+ ClO(g) △H1 k1=l.7×1011mL·(mol·s)-1
②NO(g)+ ClO(g)= NO2(g)+Cl(g) △H2 k2=8.8×1012 mL·(mol·s)-1
脱硫:③SO2(g)+ClO2(g)=SO3(g)+ClO(g) △H3 k3=2.1×10-4 mL·(mol·s)-1
④SO2(g)+ClO(g)=SO3(g)+ Cl(g) △H 4 k4=6.9×1011 mL·(mol·s)-1
两过程中产生的Cl可与ClO2进一步反应,如:
⑤C1(g)+ClO2(g)=2ClO(g) △H5
(1)同时脱硫脱硝反应NO(g)+SO2(g)+2ClO2(g)=NO2(g)+SO3(g)+ 2ClO(g)的反应热最简表达式△H=____________。
(2)己知反应③④的速率方程分別为v正=k3·c (SO2) · c (ClO2)、v正=k4·c (SO2) · c (ClO),试判断两反应的活化能大小,E3____________E4(填“>”“<”或“=”)。控制脱硫速度的关键步骤是____________反应(填③或④)
(3)SO2、NO单独氧化及同时氧化对两气体氧化率变化如图,同时氧化对____________气体的氧化率影响明显,结合①③④反应及其速率常数分析原因____________。

(4)气相中水蒸气含量提高,SO2单独氧化率会迅速提升,并生成两种常见的酸,请写出该过程化学反应方程式__________________________________。
(5)“湿式吸收法”利用吸收剂与SO2发生反应从而达脱硫目的。
①下列适合作该法吸收剂的是____________(填序号)。
A.氨水 B. Na2SO4溶液 C. Na2CO3 溶液D. NaHSO4溶液
②用石灰水也可吸收SO2,生成亚硫酸钙浊液。
计算 CaSO3(s)+H+(aq)![]() Ca2+(aq)+HSO3-(aq)的平衡常数K=____________。25℃时,H2SO3电离常数为:K1=1.41×10-2,K2=6.30×10-8 Ksp=6.76×10-3
Ca2+(aq)+HSO3-(aq)的平衡常数K=____________。25℃时,H2SO3电离常数为:K1=1.41×10-2,K2=6.30×10-8 Ksp=6.76×10-3
【答案】 △H1+△H3 > ③ SO2 k3显示单独氧化SO2时产生ClO过慢,同时氧化时反应①产生的ClO 部分与SO2作用,使SO2的氧化率提高明显。 5SO2+2ClO2+6H2O = 5H2SO4+2HCl AC 1.07×l05mol/L
【解析】(1)根据盖斯定律可知①+②即得到同时脱硫脱硝反应NO(g)+SO2(g)+2ClO2(g)=NO2(g)+SO3(g)+ 2ClO(g)的反应热最简表达式△H=△H1+△H3。(2)反应③的平衡常数很小,而反应④的平衡常数很大,因此两反应的活化能大小:E3>E4。反应③的平衡常数很小,所以控制脱硫速度的关键步骤是③反应;(3)根据图像可知k3显示单独氧化SO2时产生ClO过慢,同时氧化时反应①产生的ClO 部分与SO2作用,使SO2的氧化率提高明显。(4)气相中水蒸气含量提高,SO2单独氧化率会迅速提升,并生成两种常见的酸,说明SO2倍氧化硫酸,同时还有盐酸生成,反应的化学反应方程式为5SO2+2ClO2+6H2O=5H2SO4+2HCl。(5)①A.氨水能吸收酸性氧化物SO2,A正确;B.Na2SO4溶液与SO2不反应,B错误;C.Na2CO3 溶液显碱性,能吸收SO2,C正确;D.NaHSO4溶液与SO2不反应,D错误,答案选AC。②CaSO3(s)+H+(aq)![]() Ca2+(aq)+HSO3-(aq)的平衡常数K=
Ca2+(aq)+HSO3-(aq)的平衡常数K=![]() =
=![]() 1.07×l05mol/L。
1.07×l05mol/L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】提纯含有少量Ba(NO3)2杂质的KNO3溶液,可使用的方法为
A.加入过量Na2CO3溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量K2SO4溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量Na2SO4溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量K2CO3溶液,过滤,除去沉淀,溶液中补加适量硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原子轨道的叙述中正确的
A. 氢原子的2s轨道能量较3p能级高
B. 锂原子的2s与5s 轨道皆为球形分布
C. p能级的原子轨道呈纺锤形,随着能层序数的增加,p能级原子轨道也在增多
D. 能层n=4的原子轨道最多可容纳16个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】巴豆酸甲酯X(CH3CH=CHCOOCH3)可用于有机合成和配制香料等。其合成路线如下:
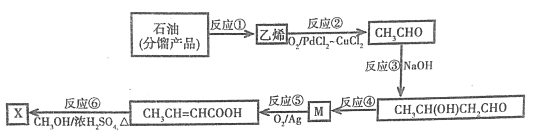
已知:醛可发生分子间的反应,生成羟基醛:
![]()
回答下列问题:
(1)由石油分馏产品制取乙烯的反应①叫做_________;上述反应中,与反应②的反应类型相同的还有反应________(填序号)。
(2)反应③的化学方程式为__________________;产物中含有的官能的结构简式是_________、_________。
(3)反应④除生成目标产物外,还有另一种有机副产物生成,该产物的结构简式:_________;该反应的反应类型为_________。
(4)反应⑥的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①MgSO4 ②Ba(NO3)2 ③NaOH ④CuCl2四种溶液,不加其他试剂就可鉴别出来,鉴别的先后顺序是( )
A. ④③①② B. ③④①② C. ②①③④ D. ③④②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在蒸馏釜中隔绝空气煅烧绿矾(FeSO4·7H2O),将蒸气冷却可制得一种无色粘稠的液体“绿矾油”,蒸馏釜中剩余的固体为红棕色。完成下列各题:
(1)绿矾油中溶质的化学式为________________________。
(2)用下图装置模拟蒸馏釜中反应并检验产物,煅烧绿矾一段时间后,发现D中U型管出现无色粘稠的液体,b中品红溶液褪色。

上述装置正确的连接顺序A→_________________________(用大写字母表示)
②写出煅烧绿矾的化学方程式________________________________________。
③实验过程中不宜加入过多绿矾,主要原因是__________________________________
(3)利用上述实验产物可比较某些离子的还原性。用足量稀硫酸将A中剩余的固体溶解,分別取2mL此溶液于2支试管中进行如下实验:
①第一支试管中加入少量酸性高锰酸钾溶液,振荡,高锰酸钾溶液紫色不褪去。说明固体产物中不含有____________。
②第二支试管中加入少量C中溶液,振荡,无沉淀生成.
③继续向第二支试管中加入少量____________溶液,产生蓝色沉淀。
以上实验现象可证明离子的还原性____________>____________。(填离子符号)
(4)绿矾在空气中部分被氧化为硫酸铁,现取3.66g绿矾样品溶于稀盐酸,加入足量的BaCl2溶液,过滤得沉淀4.66g,向溶液中通入56mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体中n(Fe2+)∶n(Fe3+)∶n(H2O)=。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 37Cl和35Cl 互为同位素
B. 白磷和红磷互为同素异形体
C. C2H4和C3H6互为同系物
D. C2H5OH和CH3OCH3互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com