
ЁОЬтФПЁПАЭЖЙЫсМзѕЅX(CH3CH=CHCOOCH3)ПЩгУгкгаЛњКЯГЩКЭХфжЦЯуСЯЕШЁЃЦфКЯГЩТЗЯпШчЯТЃК
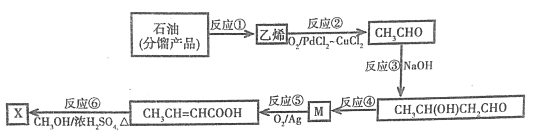
вбжЊЃКШЉПЩЗЂЩњЗжзгМфЕФЗДгІЃЌЩњГЩєЧЛљШЉЃК
![]()
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉгЩЪЏгЭЗжСѓВњЦЗжЦШЁввЯЉЕФЗДгІЂйНазі_________ЃЛЩЯЪіЗДгІжаЃЌгыЗДгІЂкЕФЗДгІРраЭЯрЭЌЕФЛЙгаЗДгІ________ЃЈЬюађКХЃЉЁЃ
ЃЈ2ЃЉЗДгІЂлЕФЛЏбЇЗНГЬЪНЮЊ__________________ЃЛВњЮяжаКЌгаЕФЙйФмЕФНсЙЙМђЪНЪЧ_________ЁЂ_________ЁЃ
ЃЈ3ЃЉЗДгІЂмГ§ЩњГЩФПБъВњЮяЭтЃЌЛЙгаСэвЛжжгаЛњИБВњЮяЩњГЩЃЌИУВњЮяЕФНсЙЙМђЪНЃК_________ЃЛИУЗДгІЕФЗДгІРраЭЮЊ_________ЁЃ
ЃЈ4ЃЉЗДгІЂоЕФЛЏбЇЗНГЬЪНЮЊ__________________ЁЃ
ЁОД№АИЁП СбНт Ђн ![]() -OH -CHO CH2=CHЁЊCH2CHO ЯћШЅЗДгІ
-OH -CHO CH2=CHЁЊCH2CHO ЯћШЅЗДгІ ![]()
ЁОНтЮіЁПЃЈ1ЃЉЗДгІЂйЮЊИпЬМЬўЭЈЙ§СбНтЕУЕНввЯЉЃЛЩЯЪіЗДгІжаЃЌЗДгІЂкЮЊбѕЛЏЗДгІЃЌЗДгІЂлЮЊМгГЩЗДгІЃЌЗДгІЂмЮЊЯћШЅЗДгІЃЌЗДгІЂнЮЊбѕЛЏЗДгІЃЌЗДгІЂоЮЊѕЅЛЏЗДгІЃЌдђгыЗДгІЂк
ЗДгІРраЭЯрЭЌЕФЛЙгаЗДгІЂнЃЛ
ЃЈ2ЃЉЗДгІЂлЮЊввШЉЗжзгМфЕФМгГЩЗДгІЃЌЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ![]() ЃЛВњЮяжаКЌгаЕФЙйФмЕФНсЙЙМђЪНЪЧ-OHЁЂ-CHOЃЛ
ЃЛВњЮяжаКЌгаЕФЙйФмЕФНсЙЙМђЪНЪЧ-OHЁЂ-CHOЃЛ
ЃЈ3ЃЉЗДгІЂмЗЂЩњЕФЪЧДМЕФЯћШЅЗДгІЃЌПЩФмЯћШЅЗНЪНгаСНжжЃЌСэвЛжжВњЮяЕФНсЙЙМђЪНЮЊCH2=CHЁЊCH2CHOЃЛ
ЃЈ4ЃЉЗДгІЂоЪЧѕЅЛЏЗДгІЃЌЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ![]() ЁЃ
ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏКЯЮяIЪЧвЛжжЙЬЬхдіЫмМСЃЌЦфКЯГЩТЗЯпШчЯТЃК
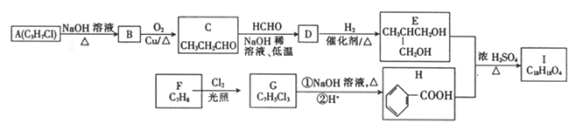
вбжЊЃКЂй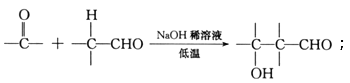 ЃЛ
ЃЛ
Ђк
ЛиД№ЯТСаЮЪЬтЃК
ЃЈlЃЉAЁњBЕФЗДгІРраЭЮЊ_________ЁЃ
ЃЈ2ЃЉDжаКЌбѕЙйФмЭХЮЊ_________ЁЃ
ЃЈ3ЃЉE+HЁњIЕФЛЏбЇЗНГЬЪНЮЊ_________ЁЃ
ЃЈ4ЃЉJЪЧDЕФЭЌЗжвьЙЙЬхЃЌТњзуЯТСаЬѕМўЕФJЕФНсЙЙга______жжЃЈВЛПМТЧСЂЬхвьЙЙЃЉЁЃ
Ђй ФмЗЂЩњвјОЕЗДгІ
Ђк ФмЗЂЩњЫЎНтЗДгІ
ЦфжаКЫДХЙВеёЧтЦзга3 зщЗхЃЌЧвЗхУцЛ§жЎБШЮЊ6:1:1ЕФНсЙЙМђЪНЮЊ_________ЁЃ
ЃЈ5ЃЉвдБНЗгЮЊдСЯПЩКЯГЩЛЏКЯЮяN:
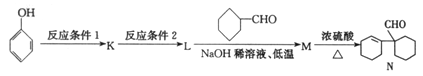
ЗДгІЬѕМўl_________ЃЛЗДгІЬѕМў2___________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЊжЄУїФГШмвКжаВЛКЌFe3+ЖјПЩФмКЌгаFe2+ЃЌдђНјааШчЯТЪЕбщВйзїЕФзюМбЫГађЮЊЃЈ ЃЉ
ЂйМгШыЩйСПТШЫЎ ЂкМгШыЩйСПKMnO4ШмвК ЂлМгШыЩйСПKSCN
A. ЂйЂл B. ЂлЂк C. ЂлЂй D. ЂйЂкЂл
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋТШЛЏФЦЁЂТШЛЏяЇЁЂТШЛЏЬњЁЂТШЛЏУОЫФжжШмвКЃЌЭЈЙ§вЛВНЪЕбщОЭФмМгвдЧјБ№ЃЌВЂжЛгУвЛжжЪдМСЃЌетжжЪдМСЪЧЃК
A. NaOH B. HCl C. KSCN D. BaCl2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСНИіЬхЛ§ЯрЭЌЕФШнЦївЛИіЪЂгаCO2,СэвЛИіЪЂгаN2КЭO2,дкЭЌЮТЭЌбЙЯТСНШнЦїФкЕФЦјЬхвЛЖЈОпгаЯрЭЌЕФ()
A. дзгзмЪ§
B. жЪзгзмЪ§
C. ЗжзгзмЪ§
D. жЪСП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШМУКбЬЦјЭбГ§SO2МАNOxЖдНтОіЮэіВЮлШОКмживЊЃЌЭбСђЭбЯѕЕФЗНЗЈКмЖрЃЌвЛжжClO2ЦјЯрбѕЛЏЗЈЗДгІЛњРэКЭЫйТЪГЃЪ§ЃЈKЃЉШчЯТ:
ЭбЯѕ:ЂйNO(g)+ ClO2(g)= NO2(g)+ ClO(g) ЁїH1 k1=l.7ЁС1011mLЁЄ(molЁЄs)-1
ЂкNO(g)+ ClO(g)= NO2(g)+Cl(g) ЁїH2 k2=8.8ЁС1012 mLЁЄ(molЁЄs)-1
ЭбСђЃКЂлSO2(g)+ClO2(g)=SO3(g)+ClO(g) ЁїH3 k3=2.1ЁС10-4 mLЁЄ(molЁЄs)-1
ЂмSO2(g)+ClO(g)=SO3(g)+ Cl(g) ЁїH 4 k4=6.9ЁС1011 mLЁЄ(molЁЄs)-1
СНЙ§ГЬжаВњЩњЕФClПЩгыClO2НјвЛВНЗДгІЃЌШч:
ЂнC1(g)+ClO2(g)=2ClO(g) ЁїH5
ЃЈ1ЃЉЭЌЪБЭбСђЭбЯѕЗДгІNO(g)+SO2(g)+2ClO2(g)=NO2(g)+SO3(g)+ 2ClO(g)ЕФЗДгІШШзюМђБэДяЪНЁїH=____________ЁЃ
ЃЈ2ЃЉМКжЊЗДгІЂлЂмЕФЫйТЪЗНГЬЗжeЮЊvе§=k3ЁЄc (SO2) ЁЄ c (ClO2)ЁЂvе§=k4ЁЄc (SO2) ЁЄ c (ClO)ЃЌЪдХаЖЯСНЗДгІЕФЛюЛЏФмДѓаЁЃЌE3____________E4ЃЈЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБЃЉЁЃПижЦЭбСђЫйЖШЕФЙиМќВНжшЪЧ____________ЗДгІЃЈЬюЂлЛђЂмЃЉ
ЃЈ3ЃЉSO2ЁЂNOЕЅЖРбѕЛЏМАЭЌЪБбѕЛЏЖдСНЦјЬхбѕЛЏТЪБфЛЏШчЭМЃЌЭЌЪБбѕЛЏЖд____________ЦјЬхЕФбѕЛЏТЪгАЯьУїЯдЃЌНсКЯЂйЂлЂмЗДгІМАЦфЫйТЪГЃЪ§ЗжЮідвђ____________ЁЃ

ЃЈ4ЃЉЦјЯржаЫЎеєЦјКЌСПЬсИпЃЌSO2ЕЅЖРбѕЛЏТЪЛсбИЫйЬсЩ§ЃЌВЂЩњГЩСНжжГЃМћЕФЫсЃЌЧыаДГіИУЙ§ГЬЛЏбЇЗДгІЗНГЬЪН__________________________________ЁЃ
ЃЈ5ЃЉЁАЪЊЪНЮќЪеЗЈЁБРћгУЮќЪеМСгыSO2ЗЂЩњЗДгІДгЖјДяЭбСђФПЕФЁЃ
ЂйЯТСаЪЪКЯзїИУЗЈЮќЪеМСЕФЪЧ____________ЃЈЬюађКХЃЉЁЃ
AЃЎАБЫЎ BЃЎ Na2SO4ШмвК CЃЎ Na2CO3 ШмвКDЃЎ NaHSO4ШмвК
ЂкгУЪЏЛвЫЎвВПЩЮќЪеSO2ЃЌЩњГЩбЧСђЫсИЦзЧвКЁЃ
МЦЫу CaSO3(s)+H+(aq)![]() Ca2+(aq)+HSO3-(aq)ЕФЦНКтГЃЪ§K=____________ЁЃ25ЁцЪБЃЌH2SO3ЕчРыГЃЪ§ЮЊЃКK1=1.41ЁС10-2ЃЌK2=6.30ЁС10-8 Ksp=6.76ЁС10-3
Ca2+(aq)+HSO3-(aq)ЕФЦНКтГЃЪ§K=____________ЁЃ25ЁцЪБЃЌH2SO3ЕчРыГЃЪ§ЮЊЃКK1=1.41ЁС10-2ЃЌK2=6.30ЁС10-8 Ksp=6.76ЁС10-3
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкУмБеШнЦїжаЗЂЩњШчЯТЗДгІЃКmA(g)+nB(g) ![]() pC(g)ЃЌДяЕНЦНКтКѓЃЌБЃГжЮТЖШВЛБфЃЌНЋЦјЬхЬхЛ§ЫѕаЁЕНдРДЕФ1/2ЃЌЕБДяЕНаТЦНКтЪБЃЌCЕФХЈЖШЮЊдРДЕФ1.5БЖЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
pC(g)ЃЌДяЕНЦНКтКѓЃЌБЃГжЮТЖШВЛБфЃЌНЋЦјЬхЬхЛ§ЫѕаЁЕНдРДЕФ1/2ЃЌЕБДяЕНаТЦНКтЪБЃЌCЕФХЈЖШЮЊдРДЕФ1.5БЖЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. ![]() B. ЦНКтЯђФцЗДгІЗНЯђвЦЖЏ
B. ЦНКтЯђФцЗДгІЗНЯђвЦЖЏ
C. AЕФзЊЛЏТЪМѕаЁ D. CЕФЬхЛ§ЗжЪ§діМг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮлШОЮяЕФгааЇШЅГ§КЭзЪдДЕФГфЗжРћгУЪЧЛЏбЇдьИЃШЫРрЕФживЊбаОППЮЬтЁЃСђЁЂЕЊбѕЛЏЮяЪЧаЮГЩЫсгъЁЂЮэіВЕШЛЗОГЮлШОЕФзяП§ЛіЪзЃЌВЩгУКЯЪЪЕФДыЪЉЯћГ§ЦфЮлШОЪЧБЃЛЄЛЗОГЕФживЊДыЪЉЁЃ
IЃЎбаОПЗЂЯжРћгУNH3ПЩЯћГ§ЯѕЫсЙЄвЕЮВЦјжаЕФNOЮлШОЁЃNH3гыNOЕФЮяжЪЕФСПжЎБШЗжБ№ЮЊ1ЃК3ЁЂ3:1ЁЂ4:1ЪБЃЌNOЭбГ§ТЪЫцЮТЖШБфЛЏЕФЧњЯпШчЭМЫљЪОЁЃ

(1)ЂйЧњЯпaжаЃЌNOЕФЦ№ЪМХЈЖШЮЊ6ЁС10-4mg/m3ЃЌДгA ЕуЕНBЕуОЙ§0.8 sЃЌИУЪБМфЖЮФкNOЕФЭбГ§ЫйТЪЮЊ____________mgЃЏ(m3ЁЄs)ЁЃ
ЂкЧњЯпbЖдгІЕФNH3гыNOЕФЮяжЪЕФСПжЎБШЪЧ____ЃЌЦфРэгЩЪЧ___________________
(2)вбжЊдк25ЁцЃЌ101 kPaЪБЃК

ЧыаДГігУNH3ЭбГ§NOЕФШШЛЏбЇЗНГЬЪНЃК____________________________________
ЂђЃЎЙЄвЕЩЯЛЙПЩвдБфЁАЗЯЁБЮЊЁАБІЁБЃЌНЋЮэіВРяКЌгаЕФSO2ЁЂNOЕШЮлШОЮязЊЛЏЮЊNa2S2O4(БЃЯеЗл)КЭNH4NO3ЕШЛЏЙЄгУЦЗЃЌЦфЩњВњСїГЬШчЯТЭМЃК

(3)зАжУЂђжаNOзЊБфЮЊNO3-ЕФЗДгІЕФРызгЗНГЬЪНЮЊ__________________________________
(4)зАжУЂѓЛЙПЩвдЪЙCe4+дйЩњЃЌШєгУМзЭщШМСЯЕчГиЕчНтИУзАжУжаЕФШмвКЃЌЕБЯћКФ1 mol CH4 ЪБЃЌРэТлЩЯПЩдйЩњ____mol Ce4+ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЂёЁЂЗДгІFeЃЋH2SO4===FeSO4ЃЋH2ЁќЕФФмСПБфЛЏЧїЪЦЃЌ
ШчЭМЫљЪОЃК
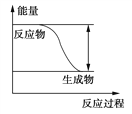
ЃЈ1ЃЉИУЗДгІЮЊ________ЗДгІ(ЬюЁАЮќШШЁБЛђЁАЗХШШЁБ)ЁЃ
ЃЈ2ЃЉШєвЊЪЙИУЗДгІЕФЗДгІЫйТЪМгПьЃЌЯТСаДыЪЉПЩааЕФЪЧ________(ЬюзжФИ)ЁЃ
AЃЎИФЬњЦЌЮЊЬњЗл BЃЎИФЯЁСђЫсЮЊ98%ЕФХЈСђЫс CЃЎЩ§ИпЮТЖШ
ЃЈ3ЃЉШєНЋЩЯЪіЗДгІЩшМЦГЩдЕчГиЃЌЭЮЊдЕчГиФГвЛМЋВФСЯЃЌдђЭЮЊ_______МЋ(ЬюЁАе§ЁБЛђЁАИКЁБ)ЃЛ ЭЕчМЋЩЯЗЂЩњЕФЕчМЋЗДгІЮЊ__________________ЁЃ
ЂђЁЂФГЮТЖШЪБЃЌдк5 LЕФШнЦїжаЃЌXЁЂYЁЂZШ§жжЦјЬхЕФЮяжЪЕФСПЫцЪБМфЕФБфЛЏЧњЯпШчЭМЫљЪОЁЃЧыЭЈЙ§МЦЫуЛиД№ЯТСаЮЪЬтЃК
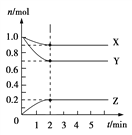
ЃЈ4ЃЉЗДгІПЊЪМжС2 minЃЌYЕФЦНОљЗДгІЫйТЪ________ЁЃ
ЃЈ5ЃЉЗжЮігаЙиЪ§ОнЃЌаДГіXЁЂYЁЂZЕФЗДгІЗНГЬЪН______________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com