
����Ŀ����Ⱦ�����Чȥ������Դ�ij�������ǻ�ѧ�츣�������Ҫ�о����⡣�����������γ����ꡢ�����Ȼ�����Ⱦ��������ף����ú��ʵĴ�ʩ��������Ⱦ�DZ�����������Ҫ��ʩ��
I���о���������NH3���������Ṥҵβ���е�NO��Ⱦ��NH3��NO�����ʵ���֮�ȷֱ�Ϊ1��3��3:1��4:1ʱ��NO�ѳ������¶ȱ仯��������ͼ��ʾ��

(1)������a�У�NO����ʼŨ��Ϊ6��10-4mg/m3����A �㵽B�㾭��0.8 s����ʱ�����NO���ѳ�����Ϊ____________mg��(m3��s)��
������b��Ӧ��NH3��NO�����ʵ���֮����____����������___________________
(2)��֪��25����101 kPaʱ��

��д����NH3�ѳ�NO���Ȼ�ѧ����ʽ��____________________________________
������ҵ�ϻ����Ա�������Ϊ���������������ﺬ�е�SO2��NO����Ⱦ��ת��ΪNa2S2O4(���շ�)��NH4NO3�Ȼ�����Ʒ����������������ͼ��

(3)װ������NOת��ΪNO3-�ķ�Ӧ�����ӷ���ʽΪ__________________________________
(4)װ����������ʹCe4+���������ü���ȼ�ϵ�ص���װ���е���Һ��������1 mol CH4 ʱ�������Ͽ�����____mol Ce4+��
���𰸡� 1.5��10-4 3:1 NH3��NO�����ʵ�����ֵԽ��NO���ѳ���Խ�� 4NH3(g)+6NO(g)�T5N2(g)+6H2O(1)��H=(3Q2-2Q1-3Q3)KJ/mol 3Ce4++NO+2H2O�T3Ce3++NO3-+4H+ 8
������������(1)������a�У�NO����ʼŨ��Ϊ6��10-4mg/m3��A����ѳ���Ϊ55%��B����ѳ���Ϊ75%����A�㵽B�㾭��0.8s����ʱ�����NO���ѳ�����=![]() =1.5��10-4mg/(m3s)���ʴ�Ϊ��1.5��10-4��
=1.5��10-4mg/(m3s)���ʴ�Ϊ��1.5��10-4��
��NH3��NO�����ʵ����ı�ֵԽ��NO�ѳ���Խ�������ʵ���֮�ȷֱ�Ϊ1��3��3��1��4��1ʱ����Ӧ������Ϊc��b��a��������b��ӦNH3��NO�����ʵ���֮����3��1���ʴ�Ϊ��3��1��NH3��NO�����ʵ�����ֵԽ��NO���ѳ���Խ��
(2)��N2(g)+3H2(g)�T2NH3(g)��H=-Q1/mol����2H2(g)+O2(g)�T2H2O(1)��H=-Q2kJ/mo1����N2(g)+O2(g)�T2NO(g)��H=+Q3kJ/mo1����NH3�ѳ�NO�Ļ�ѧ����ʽΪ4NH3(g)+6NO(g)�T5N2(g)+6H2O(1)���ɸ��ݸ�˹���ɣ���3����-2����-3�����ɵ��Ȼ�ѧ����ʽ4NH3(g)+6NO(g)�T5N2(g)+6H2O(1)��H=(3Q2-2Q1-3Q3)KJ/mol���ʴ�Ϊ��4NH3(g)+6NO(g)�T5N2(g)+6H2O(1)��H=(3Q2-2Q1-3Q3)KJ/mol��
����SO2��NO�Ǵ�����Ⱦ�ͨ������������Һ���յõ����������ƣ�һ����������Ӧ��ͨ��װ��������Ce4+������ԭ��Ӧ�õ�Ce3+��NO2-��NO3-�ȣ������������ƻ�ϣ��ڵ�����ͨ����õ�Ce4+ѭ��ʹ�ã����Na2S2O4��NO2-��NO3-�ȼ��백����������װ�����з�����Ӧ�õ�NH4NO3��Ʒ��
(3)װ������NOת��ΪNO3-�ķ�Ӧ�����ӷ���ʽΪ3Ce4++NO+2H2O�T3Ce3++NO3-+4H+���ʴ�Ϊ��3Ce4++NO+2H2O�T3Ce3++NO3-+4H+��
(4)����1 mol CH4 ת�Ƶ���8mol����������ͼ�����Խ�8mol Ce3+ת��ΪCe4+���ʴ�Ϊ��8��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ȲΪԭ�ϣ�ͨ����ͼ��ʾ�����ܺϳ�һ�ָ߷��ӵ���G��ת�������еIJ��ַ�Ӧ���������ֲ�������ȥ����

����A��B��C��D�ֱ����һ���л��B����������
��֪��-C��CH+ 
![]()
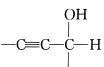

��ش��������⣺
��1��A��B�Ļ�ѧ��Ӧ������______��
д��B��C�Ļ�ѧ��Ӧ����ʽ��____________��
��2��E ��H2��ȫ�ӳɵõ������ʵĽṹ��ʽ��____________��
��3��д����������������E��ͬ���칹��________��
�ٺ��б��� ���������� �ۿɷ���������Ӧ �ܱ����������ֲ�ͬ������H��
��4������˵����ȷ����______������ĸ���ţ���
A�����������У���Ȳ���л���B���л���E���ɷ����ۺϷ�Ӧ
B.�л���E��ʹ����KMnO4��Һ��ɫ����˵��E��̼̼˫��
C.�л���C������Ϊ����ȩ�����л�ԭ��
D. 35%��40%�ļ�ȩ��HCHO����Һ�׳Ƹ���������Һ����ʹ�����ʱ���
��5����Ȼ��ά����ʪ�����ںϳ���ά�����кϳ���ά����ʪ�ԽϺõ���____������ĸ���ţ���
A����������ά�����ڣ� B.������ά�����ڣ�
C������ϩ������ȩ��ά��ά�ڣ� D���۱�ϩ��ά�����ڣ�
��6����д��F����G�Ļ�ѧ��Ӧ����ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͷ������X(CH3CH=CHCOOCH3)�������л��ϳɺ��������ϵȡ���ϳ�·�����£�
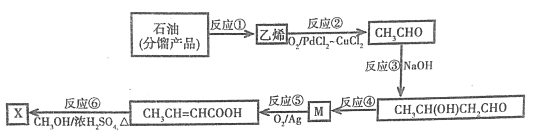
��֪��ȩ�ɷ������Ӽ�ķ�Ӧ�������ǻ�ȩ��
![]()
�ش��������⣺
��1����ʯ�ͷ����Ʒ��ȡ��ϩ�ķ�Ӧ�ٽ���_________��������Ӧ�У��뷴Ӧ�ڵķ�Ӧ������ͬ�Ļ��з�Ӧ________������ţ���
��2����Ӧ�۵Ļ�ѧ����ʽΪ__________________�������к��еĹ��ܵĽṹ��ʽ��_________��_________��
��3����Ӧ�ܳ�����Ŀ������⣬������һ���л����������ɣ��ò���Ľṹ��ʽ��_________���÷�Ӧ�ķ�Ӧ����Ϊ_________��
��4����Ӧ�Ļ�ѧ����ʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и������������̷���FeSO4��7H2O��,��������ȴ���Ƶ�һ����ɫճ����Һ�塰�̷��͡���������ʣ��Ĺ���Ϊ����ɫ��������и���:
��1���̷��������ʵĻ�ѧʽΪ________________________��
��2������ͼװ��ģ�������з�Ӧ�������������̷�һ��ʱ�����D��U�ܳ�����ɫճ����Һ�壬b��Ʒ����Һ��ɫ��

����װ����ȷ������˳��A��_________________________���ô�д��ĸ��ʾ)
��д�������̷��Ļ�ѧ����ʽ________________________________________��
��ʵ������в��˼�������̷�����Ҫԭ����__________________________________
��3����������ʵ�����ɱȽ�ijЩ���ӵĻ�ԭ�ԡ�������ϡ���ὫA��ʣ��Ĺ����ܽ⣬�քeȡ2mL����Һ��2֧�Թ��н�������ʵ�飺
�ٵ�һ֧�Թ��м����������Ը��������Һ�������������Һ��ɫ����ȥ��˵����������в�����____________��
�ڵڶ�֧�Թ��м�������C����Һ�����������ɣ�
�ۼ�����ڶ�֧�Թ��м�������____________��Һ��������ɫ������
����ʵ�������֤�����ӵĻ�ԭ��____________>____________���������ӷ��ţ�
��4���̷��ڿ����в��ֱ�����Ϊ����������ȡ3.66g�̷���Ʒ����ϡ���ᣬ����������BaCl2��Һ�����˵ó���4.66g������Һ��ͨ��56mL����״��������ǡ�ý�Fe2+��ȫ�������Ʋ⾧����n(Fe2+)��n(Fe3+)��n(H2O)=��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���ķ���ʽΪC4H8O2�������й���ͬ���칹����Ŀ��˵������ȷ����(����)
A. �����������4��
B. �����������3��
C. �Ⱥ����ǻ��ֺ���ȩ������3��
D. �����ܴ��ڷ����к�����Ԫ����ͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ�������
A. 37Cl��35Cl ��Ϊͬλ��
B. ���ͺ���Ϊͬ��������
C. C2H4��C3H6��Ϊͬϵ��
D. C2H5OH��CH3OCH3��Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ӱ�����ǵ������뽡����ij�����������п��ܺ������¿����������ӣ�Na����NH4+��Mg2����Al3����SO42����NO3-��Cl����ijͬѧ�ռ��˸õ���������������Ҫ��Ԥ�������������Һ����Ʋ����������ʵ�飺

��֪��3NO3-��8Al��5OH����2H2O![]() 3NH3����8AlO2-
3NH3����8AlO2-
�������ϵ�ʵ�����������ͬѧ�ó��Ľ��۲���ȷ����( )
A�������п϶�����NH4+��Mg2����SO42����NO3-
B��������һ������Al3��
C�������п��ܴ���Na����Cl��
D���������п��ܴ���NaNO3��NH4Cl��MgSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£�Al��Fe3O4��Ӧ����Fe��Al2O3������˵����ȷ����

A. �÷�Ӧ�����е������仯��ͼ��ʾ
B. �÷�Ӧ�����£�Al�Ļ�ԭ������Fe
C. 1molFe3O4���뷴Ӧת��8��6.02��1023������
D. ʵ���ҽ��и÷�Ӧʱ������KClO3������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ƶ������У�����ȷ����
A. ��ȼ��ʱ������ɫ�Ļ��� B. ��ȼ��ʱ����������
C. ���к�ǿ�Ļ�ԭ�� D. ��ԭ�ӵ������ֻ��һ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com