
����Ŀ��Ϊ��������̼������СCO2�Ի�����Ӱ�죬���CO2���д��������о���T1��ʹ������9 mol CO2��12 mol H2����3 L�ܱ�������,������ӦCO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H��0��������CH3OH�����ʵ�����ʱ��仯�����ߢ���ʾ,ƽ��ʱ������ѹǿΪp0���ı�ijһ�������½���������Ӧ��CH3OH�����ʵ�����ʱ��仯�����ߢ���ʾ������˵���������
CH3OH(g)+H2O(g) ��H��0��������CH3OH�����ʵ�����ʱ��仯�����ߢ���ʾ,ƽ��ʱ������ѹǿΪp0���ı�ijһ�������½���������Ӧ��CH3OH�����ʵ�����ʱ��仯�����ߢ���ʾ������˵���������
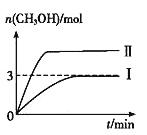
A. ���ߢ��Ӧ�������ı�������ѹǿ
B. T2��ʱ,������Ӧƽ�ⳣ��Ϊ0.52����T2>T1
C. ��T1�棬����ʼʱ����������4.5 mol CO2��6 mol H2��ƽ��ʱ������ѹǿP1>P0/2
D. ��T1��,����ʼʱ�������г���4.5 mol CO2��5 mol H2��5 mol CH3OH(g)��5 mol H2O(g)�����ƽ��ǰv(��)>v(��)
���𰸡�B
��������A������ѹǿ����ѧ��Ӧ�������ﵽƽ������ʱ��϶̣�����ѹǿ��ƽ��������Ӧ������У��״������ʵ�������A˵����ȷ��B��
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
��ʼ�� 9 12 0 0
�仯�� 3 9 3 3
ƽ�⣺ 6 3 3 3 ���ݻ�ѧƽ�ⳣ���ı���ʽ��K=c(CH3OH)��c(H2O)/[c3(H2)��c(CO2)]=(1��1)/(13��2)=0.5�� 0.5<0.52��˵����Ӧ��������Ӧ������У��˷�Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ������У���T2<T1����B˵������C����9molCO2��12molH2�Ļ����ϼ���һ�룬����ƽ�ⲻ�ƶ�����ʱ��ѹǿ��ԭ����һ�룬��Ӧ���Ũ�ȼ��٣�ƽ�����淴Ӧ�����ƶ����������ʵ�������P1>P0/2����C˵����ȷ��D����ʱ��Ũ����Qc= 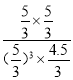 =0.4<0.5��˵����Ӧ������Ӧ�����ƶ�����v(��)>v(��) ����D˵����ȷ��
=0.4<0.5��˵����Ӧ������Ӧ�����ƶ�����v(��)>v(��) ����D˵����ȷ��


 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬѧ������FeCl2��Һ�����ơ�Ũ�ȵIJⶨ�Լ�Fe2+��ԭ�Ե�ʵ�飬������쳣�������̽����
����һ����ȡFeCl2��ͬѧ�������ַ�����ȡ��
����1������ͼװ����H2��ԭ��ˮFeCl3��ȡ��
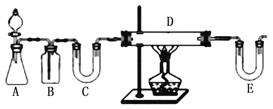
E��ʢ�ŵ��Լ���____________��D�з�Ӧ�Ļ�ѧ����ʽΪ____________���˷����и����Ե�ȱ����___________________________��
����2����0.1 molL-1 FeCl3��Һ��ȡFeCl2��Һ������Ϊ�����Ӧ����____________ ��
��������ⶨ����2����FeCl2��Һ�����ʵ���Ũ�ȡ����ظ���ط���һ��������ԭ�ζ������ɴﵽĿ�ġ���������Ũ��Ϊ0.01000 mol��L��1��K2Cr2O7����Һ480 mL��ʵ�����õ��IJ�����������Ͳ�����������ձ�����ȱ��_______________��
��ʵ��ζ������в����ζ��ܵ�ͼʾ��ȷ����____________(����)��
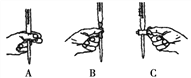
���д���IJ���ʹ�ⶨ��FeCl2 ��ҺŨ��ƫС����______________��
A����������K2Cr2O7����Һ����ʱ��ȡ��������
B�����ζ������У�����ζ�ǰװ��K2Cr2O7����Һ�ĵζ��ܼ��첿�������ݣ����ζ�������������ʧ��
C����ƿϴ����δ����
����������2 mL FeCl2��Һ�еμ�2��0.1 mol��L-1 KSCN��Һ���������ٵμ�5��5% H2O2��Һ�����ʵ���Ũ��ԼΪ1.5 mol��L-1��pHԼΪ5�����۲쵽��Һ��죬��Լ10�����Һ�ɫ��ȥ�����������ɣ�������ΪO2����
��ͬѧ̽����������������Һ��ɫ��ԭ��
ʵ��I��ȡ��ɫ����Һ���ݣ�һ�ݵμ�FeCl3��Һ��������һ�ݵμ�KSCN��Һ���ֺ�ɫ��
ʵ��II��ȡ��ɫ����Һ���μ������BaCl2��Һ��������ɫ��������������������ֿ�ֱ���ŷŵ������е����塣
ʵ��III����2 mL 0.1 mol��L-1 FeCl3��Һ�еμ�2��0.1 molL-1 KSCN��Һ����죬ͨ��O2�������Ա仯��
��ʵ��I˵����Һ��ɫ��ȥ����ΪSCN�������˷�Ӧ������Fe3��������Ӧ��
��ʵ��III��Ŀ����_____________________��
�ó����ۣ���Һ��ɫ��ԭ��������������H2O2��SCN-������SO42����������塣д���÷�Ӧ�����ӷ���ʽ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������������SiO2��Fe2O3��Fe��Na2SO3��Na2CO3��BaCl2�е����ֻ��������ϵ�������ɡ�ij��ȤС��Ϊ̽���ù����������ɣ���ƵIJ���ʵ�鷽������ͼ��ʾ��
����˵����ȷ����

A. ����A��SO2��CO2�Ļ������
B. ����Aһ������SiO2�����ܺ���BaSO4
C. �ù���������Fe2O3��Fe����������һ��
D. �ù�������һ������Fe��Na2SO3��BaCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���Т�![]() ��
��![]() ��
��![]() ��H2��D2��T2 ��ʯī�����ʯ ��
��H2��D2��T2 ��ʯī�����ʯ ��![]() ��
��![]() ��
��![]() �����������ʡ���Ϊͬλ�ص���__________________(����)��
�����������ʡ���Ϊͬλ�ص���__________________(����)��
��2�����������У���N2����MgCl2����NH4Cl����CH4����CO2����Ne����H2S����KOH����Na2O2����K2O ֻ���ڹ��ۼ�����___________���������ӻ���������й��ۼ�����______��
(3) �õ���ʽ��ʾ�������ʣ�
MgCl2___________N2___________NH4+___________Na2O2___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017��4��11����12�գ��й�ʯ�����Ź�˾2017����ܽ�̼������̸��������������ʤ��������̨��ѵ�����ٿ�������Ҫ����λҪ�ι�������ɫ��չ�����ַ��ӽ��ܼ���һ�廯���ƣ���ʵ���ü�������������ŷŹ����������������������������
A. N2 B. H2 C. CO2 D. O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ư�۵ijɷ���Ҫ��A
A���Ȼ��� B��������� C���Ȼ����������� D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Iд������л�������Ľṹʽ��_________��
II��֪������̬��A�ڱ�״���µ��ܶ�Ϊ1.25g/L
��2CH3CHO+O2![]() 2CH3COOH��
2CH3COOH��
A�������������ʵ�ת����ϵ��ͼ��ʾ��CH3COOH��CH3CHO![]() C2H5OH
C2H5OH ![]() A
A![]() C2H5Br��
C2H5Br��
��1��A�Ľṹ��ʽΪ__��
��2����Ӧ�ٵĻ�ѧ����ʽΪ______________________��
��3����Ӧ�۵Ļ�ѧ����ʽΪ_____________________����Ӧ����Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ�е��뷽��ʽ�ɱ�ʾΪ��CH3COOH![]() CH3COO��+H+ ��H>0�����в�����ʹH+ Ũ��������� ( )
CH3COO��+H+ ��H>0�����в�����ʹH+ Ũ��������� ( )
A. ��������NaOH���� B. С�ļ�������10oC C. ����п�� D. �������CH3COONa
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú������Ҫ�ĺ���������H2S�Լ�COS���л���ú��ȼ�պ������ʻ�ת����SO2�Ӷ����������Ⱦ��ú����H2S���ѳ��̶��ѳ�Ϊ��ྻ�ȵ�һ����Ҫָ�ꡣ�ش��������⣺
(1)��H2Sͨ��FeCl3��Һ�У��÷�Ӧ�Ļ�ԭ����Ϊ___________��
(2)�ѳ�ú����COS�ķ�����Br2��KOH��Һ��������H2��ԭ���Լ�ˮ�ⷨ�ȡ�
��COS�ķ��ӽṹ��CO2���ƣ�COS�ĵ���ʽΪ_____________��
��Br2��KOH��Һ��COS����Ϊ�����κ�̼���ε����ӷ���ʽΪ_____________��
����֪����1mol��ѧ��������������£�
��ѧ�� | H��H | C�TO | C�TS | H��S | C��O |
E/kJmol-1 | 436 | 745 | 577 | 339 | 1072 |
H2��ԭCOS�����ķ�ӦΪH2(g)+COS(g) �TH2S(g)+CO(g)���÷�Ӧ�Ħ�H=________kJ��mol-1��
���û��Ԧ���Al2O3��COSˮ��ķ�ӦΪCOS(g)+ H2 O(g) ![]() CO2(g)+ H2S (g) ��H<0����ͬͶ�ϱȡ���ͬ�������ڴ�������ͣ����ͬʱ��ʱ����ͬ�¶���COS��ת���ʣ�δ�ﵽƽ�⣩��ͼ1��ʾ��ij�¶��£�COS��ƽ��ת������
CO2(g)+ H2S (g) ��H<0����ͬͶ�ϱȡ���ͬ�������ڴ�������ͣ����ͬʱ��ʱ����ͬ�¶���COS��ת���ʣ�δ�ﵽƽ�⣩��ͼ1��ʾ��ij�¶��£�COS��ƽ��ת������![]() �Ĺ�ϵ��ͼ2��ʾ��
�Ĺ�ϵ��ͼ2��ʾ��
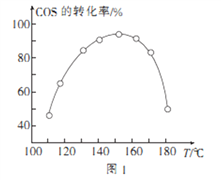

��ͼ1��֪�������������ʱ��Ӧ���¶�ԼΪ____________����ͼ2��֪��P��ʱƽ�ⳣ��K=_____
������2λ��Ч���֣���
(3)�����¿ɷ�����Ӧ��ZnS(s)+2H+(aq) ![]() Zn2+(aq)+H2S(aq)���ﵽƽ��ʱ���÷�Ӧ��ƽ�ⳣ��K=_______[��֪��Ksp(ZnS)=2.93��10-25��H2S���볣����Ka1=9.5��10-8��Ka2=1.3��10-14]��
Zn2+(aq)+H2S(aq)���ﵽƽ��ʱ���÷�Ӧ��ƽ�ⳣ��K=_______[��֪��Ksp(ZnS)=2.93��10-25��H2S���볣����Ka1=9.5��10-8��Ka2=1.3��10-14]��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com