
【题目】煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染。煤气中H2S的脱除程度已成为其洁净度的一个重要指标。回答下列问题:
(1)将H2S通入FeCl3溶液中,该反应的还原产物为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法以及水解法等。
①COS的分子结构与CO2相似,COS的电子式为_____________。
②Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为_____________。
③已知断裂1mol化学键所需的能量如下:
化学键 | H—H | C═O | C═S | H—S | C≡O |
E/kJmol-1 | 436 | 745 | 577 | 339 | 1072 |
H2还原COS发生的反应为H2(g)+COS(g) ═H2S(g)+CO(g),该反应的ΔH=________kJ·mol-1。
④用活性α—Al2O3催化COS水解的反应为COS(g)+ H2 O(g) ![]() CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与
CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与![]() 的关系如图2所示。
的关系如图2所示。
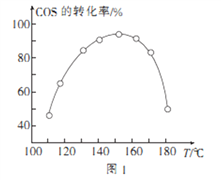

由图1可知,催化剂活性最大时对应的温度约为____________;由图2可知,P点时平衡常数K=_____
(保留2位有效数字)。
(3)常温下可发生反应:ZnS(s)+2H+(aq) ![]() Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______[已知:Ksp(ZnS)=2.93×10-25;H2S电离常数;Ka1=9.5×10-8,Ka2=1.3×10-14]。
Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______[已知:Ksp(ZnS)=2.93×10-25;H2S电离常数;Ka1=9.5×10-8,Ka2=1.3×10-14]。
【答案】 Fe2+(或FeCl2) ![]() COS+4Br2+12OH-═CO32-+SO42-+8Br-+6H2O +8 150℃ 0.048 2.4×10-4(或2.37×10-4)
COS+4Br2+12OH-═CO32-+SO42-+8Br-+6H2O +8 150℃ 0.048 2.4×10-4(或2.37×10-4)
【解析】(1)将H2S通入FeCl3溶液中,反应为:H2S+2Fe3+=S↓+2Fe2++2H+,Fe3+被还原为Fe2+,故还原产物为Fe2+(或FeCl2)。
(2)①COS的分子结构与CO2相似,故COS的电子式为![]() ;②碱性溶液,OH-参与反应,生成水,Br2作氧化剂被还原为Br-,故Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为:COS+4Br2+12OH-=CO32-+SO42-+8Br-+6H2O;③ΔH=(436+745+577-2×339-1072)kJ·mol-1=+8kJ·mol-1;④由图1可得,相同投料比、相同流量且在催化剂表面停留相同时间时,150℃时COS转化率最大,所以该温度下反应速率最快,催化剂活性最大;由图2,可列三段式:
;②碱性溶液,OH-参与反应,生成水,Br2作氧化剂被还原为Br-,故Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为:COS+4Br2+12OH-=CO32-+SO42-+8Br-+6H2O;③ΔH=(436+745+577-2×339-1072)kJ·mol-1=+8kJ·mol-1;④由图1可得,相同投料比、相同流量且在催化剂表面停留相同时间时,150℃时COS转化率最大,所以该温度下反应速率最快,催化剂活性最大;由图2,可列三段式:
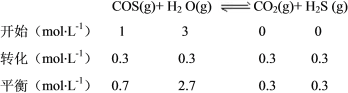
K=![]() =
=![]() =
=![]() ≈0.048。
≈0.048。
(3)K= 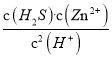 =
= ![]() ÷
÷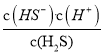 ÷
÷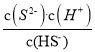 =
= ![]() =
= ![]() ≈ 2.37×10-4 。
≈ 2.37×10-4 。


科目:高中化学 来源: 题型:
【题目】为倡导“低碳”,减小CO2对环境的影响,需对CO2进行创新利用研究。T1℃使,将将9 mol CO2和12 mol H2充入3 L密闭容器中,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p0。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是
CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p0。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是
A. 曲线Ⅱ对应的条件改变是增大压强
B. T2℃时,上述反应平衡常数为0.52,则T2>T1
C. 在T1℃,若起始时向容器充入4.5 mol CO2、6 mol H2,平衡时容器内压强P1>P0/2
D. 在T1℃,若起始时向容器中充入4.5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
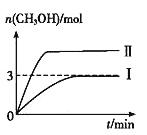
【题目】常温下,pH=10的X、Y两种碱溶液各1 mL,分别稀释到100 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
A.X、Y两种碱溶液中溶质的物质的量浓度一定相等
B.稀释后,X溶液的碱性比Y溶液的碱性强
C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积VX>VY
D.若8<a<10,则X、Y都是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )

提示:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
A. 加入Na2SO4可以使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置,下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铁片上发生的反应为:Fe-2e-=Fe2+
C. a和b用导线连接时,电子从Cu片流向铁片
D. a和b用导线连接时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为 , K+移向 极(填A、B)

(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:①A电极附近可观察到的现象是 。
②B电极上的电极反应式为 ,总反应化学方程式是 。
③反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL, 将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。
(3)如要用电解方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 ,电极反应式是 ,反应一段时间后电解质溶液中Cu2+浓度 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生下列反应,其中反应后固体质量增重的是
A. H2还原三氧化钨(WO3) B. 铝与氧化铁发生铝热反应
C. 锌粒投入硫酸铁溶液中 D. 过氧化钠吸收二氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com