
【题目】常温下,pH=10的X、Y两种碱溶液各1 mL,分别稀释到100 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
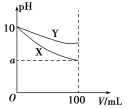
A.X、Y两种碱溶液中溶质的物质的量浓度一定相等
B.稀释后,X溶液的碱性比Y溶液的碱性强
C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积VX>VY
D.若8<a<10,则X、Y都是弱碱
 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】某固体混合物可能由SiO2、Fe2O3、Fe、Na2SO3、Na2CO3、BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如下图所示:
下列说法正确的是

A. 气体A是SO2和CO2的混合气体
B. 固体A一定含有SiO2,可能含有BaSO4
C. 该固体混合物中Fe2O3和Fe至少有其中一种
D. 该固体混合物一定含有Fe、Na2SO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I写出最简单的有机化合物的结构式:_________。
II已知:①气态烃A在标准状况下的密度为1.25g/L
②2CH3CHO+O2![]() 2CH3COOH;
2CH3COOH;
A物质与其他物质的转化关系如图所示:CH3COOH←CH3CHO![]() C2H5OH
C2H5OH ![]() A
A![]() C2H5Br则:
C2H5Br则:
(1)A的结构简式为__.
(2)反应①的化学方程式为______________________.
(3)反应③的化学方程式为_____________________,反应类型为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸在水中电离方程式可表示为:CH3COOH![]() CH3COO—+H+ ΔH>0,下列操作能使H+ 浓度增大的是 ( )
CH3COO—+H+ ΔH>0,下列操作能使H+ 浓度增大的是 ( )
A. 加入少量NaOH固体 B. 小心加热升温10oC C. 加入锌粉 D. 加入固体CH3COONa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。

(1)D的氢化物比G的氢化物________________(填“稳定”或者“不稳定”)。
(2)A与E可形成一种极易溶于水的气态化合物,该化合物溶于水后的溶液呈________性(填“酸”、“碱”或“中”)。
(3)C、H、I简单离子的半径由大到小的顺序是________________(用离子符号表示)。
(4)由C和F组成的一种化合物可用作核潜艇中氧气的来源,写出该化合物的电子式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染。煤气中H2S的脱除程度已成为其洁净度的一个重要指标。回答下列问题:
(1)将H2S通入FeCl3溶液中,该反应的还原产物为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法以及水解法等。
①COS的分子结构与CO2相似,COS的电子式为_____________。
②Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为_____________。
③已知断裂1mol化学键所需的能量如下:
化学键 | H—H | C═O | C═S | H—S | C≡O |
E/kJmol-1 | 436 | 745 | 577 | 339 | 1072 |
H2还原COS发生的反应为H2(g)+COS(g) ═H2S(g)+CO(g),该反应的ΔH=________kJ·mol-1。
④用活性α—Al2O3催化COS水解的反应为COS(g)+ H2 O(g) ![]() CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与
CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与![]() 的关系如图2所示。
的关系如图2所示。
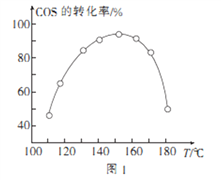

由图1可知,催化剂活性最大时对应的温度约为____________;由图2可知,P点时平衡常数K=_____
(保留2位有效数字)。
(3)常温下可发生反应:ZnS(s)+2H+(aq) ![]() Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______[已知:Ksp(ZnS)=2.93×10-25;H2S电离常数;Ka1=9.5×10-8,Ka2=1.3×10-14]。
Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______[已知:Ksp(ZnS)=2.93×10-25;H2S电离常数;Ka1=9.5×10-8,Ka2=1.3×10-14]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.乙烯的产量通常用来衡量一个国家的石油化工水平。以乙烯为主要原料合重要的有机化合物路线如下图所示。请回答下列问题。
![]()
(1)A物质所含官能团的名称是____。
(2)反应③的化学方程式是____。
(3)下列物质中,不能通过乙烯加成反应得到的是____(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
Ⅱ.葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是____。
(2)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是____。
②实验开始时,试管b中的导管不伸入液面下的原因是____。
(3)有机物E由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的E为无色粘稠液体,易溶于水.为研究E的组成与结构,进行了如下实验:
①称取E4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | ①有机物E的相对分子量为:__. |
②将此9.0gE在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况). | ②9.0g有机物E完全燃烧时,经计算:生成CO2共为____ mol. |
③经红外光谱测定,证实其中含有羟基,羧基,甲基 |
④写出E与NaHCO3溶液反应的化学方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com