
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )

提示:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。
A. 加入Na2SO4可以使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】(1)有①![]() 、
、![]() 、
、![]() ②H2、D2、T2 ③石墨、金刚石 ④
②H2、D2、T2 ③石墨、金刚石 ④![]() 、
、![]() 、
、![]() 四组微粒或物质。互为同位素的是__________________(填编号)。
四组微粒或物质。互为同位素的是__________________(填编号)。
(2)下列物质中:①N2 ②MgCl2 ③NH4Cl ④CH4 ⑤CO2 ⑥Ne ⑦H2S ⑧KOH ⑨Na2O2 ⑩K2O 只存在共价键的是___________;属于离子化合物,但含有共价键的是______。
(3) 用电子式表示下列物质:
MgCl2___________N2___________NH4+___________Na2O2___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸在水中电离方程式可表示为:CH3COOH![]() CH3COO—+H+ ΔH>0,下列操作能使H+ 浓度增大的是 ( )
CH3COO—+H+ ΔH>0,下列操作能使H+ 浓度增大的是 ( )
A. 加入少量NaOH固体 B. 小心加热升温10oC C. 加入锌粉 D. 加入固体CH3COONa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。

(1)D的氢化物比G的氢化物________________(填“稳定”或者“不稳定”)。
(2)A与E可形成一种极易溶于水的气态化合物,该化合物溶于水后的溶液呈________性(填“酸”、“碱”或“中”)。
(3)C、H、I简单离子的半径由大到小的顺序是________________(用离子符号表示)。
(4)由C和F组成的一种化合物可用作核潜艇中氧气的来源,写出该化合物的电子式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染。煤气中H2S的脱除程度已成为其洁净度的一个重要指标。回答下列问题:
(1)将H2S通入FeCl3溶液中,该反应的还原产物为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法以及水解法等。
①COS的分子结构与CO2相似,COS的电子式为_____________。
②Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为_____________。
③已知断裂1mol化学键所需的能量如下:
化学键 | H—H | C═O | C═S | H—S | C≡O |
E/kJmol-1 | 436 | 745 | 577 | 339 | 1072 |
H2还原COS发生的反应为H2(g)+COS(g) ═H2S(g)+CO(g),该反应的ΔH=________kJ·mol-1。
④用活性α—Al2O3催化COS水解的反应为COS(g)+ H2 O(g) ![]() CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与
CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与![]() 的关系如图2所示。
的关系如图2所示。
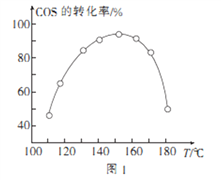

由图1可知,催化剂活性最大时对应的温度约为____________;由图2可知,P点时平衡常数K=_____
(保留2位有效数字)。
(3)常温下可发生反应:ZnS(s)+2H+(aq) ![]() Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______[已知:Ksp(ZnS)=2.93×10-25;H2S电离常数;Ka1=9.5×10-8,Ka2=1.3×10-14]。
Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______[已知:Ksp(ZnS)=2.93×10-25;H2S电离常数;Ka1=9.5×10-8,Ka2=1.3×10-14]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。完成下列填空:

(1)实验时,通常加入过量的乙醇,原因是__________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______;浓硫酸用量又不能过多,原因是_______。
(2)饱和Na2CO3溶液的作用是_______________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,______、_______,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应的最终产物中,肯定有白色沉淀的是( )
A.向AlCl3溶液中加入过量氨水 B.向Al2(SO4)3溶液中加入过量KOH溶液
C.向澄清石灰水中通入过量CO2 D.向NaAlO2溶液中加入过量稀盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com