
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。

⑴ Ⅰ中发生反应的化学方程式是 ,氧化剂与还原剂的物质的量之比是
⑵ Ⅱ中反应的离子方程式是
⑶ 装置Ⅲ中阳极的反应是 ;
⑷ ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
① 该反应中盐酸的作用是
② 写出实验室制氯气的离子方程式 ;说明上述两反应中盐酸作用不同的原因 。
【答案】
⑴2NaClO3+Na2SO3+H2SO4=2Na2SO4+2ClO2↑+H2O;2∶1;
⑵2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;
⑶4OH--4e-=2H2O+O2↑;
⑷①起酸的作用;
②MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O;盐酸浓度越大,还原性越强;
【解析】
试题分析:硫酸钠溶液通入离子隔膜电解池中,ClO2和双氧水在II中发生氧化还原反应生成NaClO2和气体a,该反应中Cl元素化合价由+4价变为+3价,则O元素化合价由-1价变为0价,所以生成的气体a是O2,离子反应方程式为2 ClO2+H2O2+2OH-=2 ClO2-+O2↑+2H2O;III中发生电解,根据图知,生成氢氧化钠,阴极上生成氢气同时阴极附近生成NaOH,所以生成的气体b是H2;阳极上氢氧根离子放电生成氧气,所以a是O2,同时生成硫酸,所以A溶液是硫酸;酸性条件下,I中NaClO2、Na2SO3发生氧化还原反应,离子反应方程式为2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O。
⑴ Ⅰ中发生反应的化学方程式为2NaClO3 + Na2SO3 + H2SO4=2Na2SO4 + 2ClO2↑+ H2O;2∶1,氧化剂为NaClO3,还原剂为Na2SO3,物质的量之比为2∶1,故答案为:2NaClO3 + Na2SO3 + H2SO4=2Na2SO4 + 2ClO2↑+ H2O;2∶1;
⑵ Ⅱ中反应的离子方程式为2ClO2 + H2O2 + 2OH-=2ClO2-+ O2↑+ 2H2O,故答案为:2ClO2 + H2O2 + 2OH-=2ClO2-+ O2↑+ 2H2O;
⑶ 装置Ⅲ中阳极的反应为4OH--4e-=2H2O + O2↑,故答案为:4OH--4e-=2H2O + O2↑;
⑷ ①5NaClO2 + 4HCl = 5NaCl + 4ClO2↑+ 2H2O反应中盐酸中氯元素的不变,盐酸的作用为酸,故答案为:起酸的作用;②实验室用二氧化锰在加热时氧化浓盐酸制氯气,反应的离子方程式为MnO2 + 4H+ + 2Cl-=Mn2++ Cl2↑+ 2H2O,该反应中盐酸起了还原剂和酸的作用,说明盐酸浓度越大,还原性越强,故答案为:MnO2 + 4H+ + 2Cl-=Mn2++ Cl2↑+ 2H2O;盐酸浓度越大,还原性越强。


科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,11.2 L H2中含有的H原子数是NA
B.标准状况下,11.2 L CCl4含有0.5 NA个分子
C.0.1 mol C含质子数为1.2 NA
D.2.3 g金属钠含有的电子数为1.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或说法正确的是( )

A.用玻璃棒蘸取CH3COOH溶液点在用水湿润的pH试纸上,测定该溶液的pH
B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前忘记加沸石,应立即停止加热,冷却后补加
C.用装置甲分液,放出水相后再从分液漏斗下口放出有机相
D.用如图装置乙加热分解NaHCO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定微粒的数目相等的是( )
A. 等物质的量的水与重水含有的中子数
B. 等物质的量的乙烯和丙烯中含有的共用电子对数
C. 同温、同压、同体积的CO和NO含有的质子数
D. 等物质的量的钠分别和足量的氧气反应生成的氧化钠和过氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)铬(24Cr)属于_______________(选填编号)。
a.主族元素 b.副族元素 c.Ⅷ族元素 d.过渡元素
(2)铬单质是银白色有金属光泽的固体,有较高的熔点,是最硬的金属;与Ni等添加到Fe中可制成不锈钢。比较硬度:纯铁_________不锈钢;熔点:纯铁__________不锈钢(填“>”“<”或“=”)。
(3)Cr(OH)3与Al(OH)3的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是___________________。
(4)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
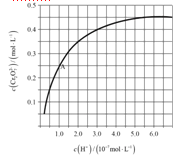
①用离子方程式表示Na2CrO4溶液中的转化反应____________________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH__________0(填“>”“<”或“=”)。
(5)+6价铬的化合物毒性较大,但其化合物用途广泛。如:“酒精检测仪”可检查司机是否酒驾,其反应原理为:m C2H5OH+ n X + p H2SO4═ g Cr2(SO4)3 + w CO2↑+ 9H2O,其中X的化学式最有可能为__________。常用NaHSO3将酸性废液中的Cr2O72还原成Cr3+,该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生产和生活中,人们早已广泛利用化学反应释放的能量。下列说法正确的是( )
A.物质发生化学变化并不一定都伴随着能量变化
B.有能量变化的都是化学变化
C.用实验方法和理论方法研究反应热的化学称为热化学
D.任何反应中的能量变化都表现为热量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子的结构如图所示,下列说法正确的是( )

A.N4属于一种新型的化合物
B.N4与N2的摩尔质量相等
C.等质量的N4与N2所含的原子个数比为1∶1
D.等质量的N4与N2所含的原子个数比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
A. 3∶2∶2 B. 1∶2∶3 C. 1∶3∶3 D. 3∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最简式相同,但既不是同系物,又不是同分异构体的是( )
A. 辛烯和3甲基1丁烯 B. 苯和乙炔
C. 1氯丙烷和2氯丙烷 D. 甲基环己烷和己炔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com