
【题目】一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法错误的是
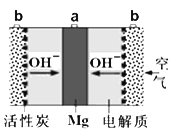
A. 电池总反应式为:2Mg+O2+2H2O=2Mg(OH)2
B. 正极反应式为:Mg-2e-=Mg2+
C. 活性炭一极为正极
D. 电子的移动方向由a经外电路到b
【答案】B
【解析】
Mg、活性炭、KOH浓溶液构成原电池,Mg易失电子作负极,活性炭为正极,负极反应式为Mg-2e-+2OH-=Mg(OH)2,正极反应式为O2+4e-+2H2O=4OH-,电子从负极沿外电路进入正极,据此分析解答;
Mg、活性炭、KOH浓溶液构成原电池,Mg易失电子作负极,活性炭为正极,负极反应式为Mg-2e-+2OH-=Mg(OH)2,正极反应式为O2+4e-+2H2O=4OH-,电子从负极沿外电路进入正极,
A、根据上述分析,负极反应式为Mg-2e-+2OH-=Mg(OH)2,正极反应式为O2+4e-+2H2O=4OH-,电池总反应式为2Mg+O2+2H2O=Mg(OH)2,故A说法正确;
B、根据上述分析,Mg为负极,电极反应式为Mg-2e-+2OH-=Mg(OH)2,故B说法错误;
C、活性炭为一极正极,故C说法正确;
D、根据原电池工作原理,电子从负极经外电路流向正极,即电子从a经外电路流向b,故D说法正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率说法正确的是( )
A.对于A(s)+B(g)![]() 2C(g)的反应,增加A的质量,反应速率加快
2C(g)的反应,增加A的质量,反应速率加快
B.对于反应N2O5![]() 2NO2+O2(正反应吸热),升高温度,v(正)减小,v(逆)增大
2NO2+O2(正反应吸热),升高温度,v(正)减小,v(逆)增大
C.恒温恒容下反应2SO2(g)+O2(g)![]() 2SO3(g),充入氦气不改变化学反应速率
2SO3(g),充入氦气不改变化学反应速率
D.1 mol·L-1稀盐酸与锌反应时,加入少量3 mol·L-1稀硝酸,生成H2的速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用电解原理间接氧化法降解处理含有机污染物的废水,其原理如图所示,下列说法错误的是

A.介质离子在电极A上发生氧化反应,电极A为阳极
B.介质离子被氧化得到的强氧化剂可能为Cl2、O2
C.有机污染物在石墨电极上被还原为无污染物质
D.若介质离子为OH-,电极B上发生的反应为2H2O+2e-=H2↑+ 2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生产生活中应用广泛。回答下列问题:
I.单质碘与氟反应可得IF5,实验表明液态IF5具有一定的导电性原因在于IF5的自偶电离(如:2H2OH3O++OH-),IF5的自偶电离方程式为_________。
II.一种回收并利用含碘(I-)废液的工艺流程如下:

(1)含碘废水中碘的存在形式一般有I2、I-。检验是否含I2及I-的方法是_______________。
(2)“沉淀”中生成CuI的离子方程式为_______________。
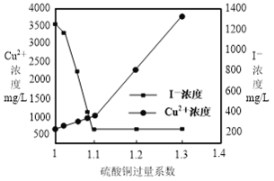
(3)CuSO4的投加量对废水中I-的去除量影响较大,不同投加量(用过量系数表示)下,反应后I-和Cu2+的浓度如图所示,则适宜的CuSO4过量系数应为_______________,分析原因_______________。
(4)反应Ⅰ中生成铁与碘的化合物(其中铁与碘的质量比为21:127),则加入的水的作用是__________,反应Ⅱ的化学方程式是_____________________________。
(5)氯化银复合吸附剂可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s) AgI(s)+Cl-(aq),反应达到平衡后溶液中c(Cl-)=0.10molL-1。则溶液中c(I-)= ______molL-1。[Ksp(AgCl)=2.0×10-10,Ksp (AgI)=8.4×10-17]。该方法能去除碘离子的原理是_________。
(6)准确称取产品0.1000g溶于50mL水,加入适量乙酸并加入曙红钠指示剂,然后用0.025mol·L-1AgNO3溶液滴定,至终点时消耗AgNO3溶液22.00mL,则产品中KI的质量分数为____________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强。利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法错误的是
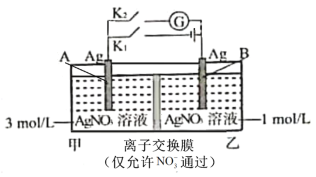
A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池Ag+浓度相等
B.断开K1、闭合K2,当转移0.1mol e-时,乙池溶液质量增加17.0 g
C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是( )
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.一定条件下的可逆反应达到限度时,此条件下反应物的转化率最大
B.化学反应限度的大小主要取决于反应物的性质,且随条件的改变而改变
C.化学反应限度随外界条件的改变而改变的根本原因是外界条件的改变引起v正≠v逆
D.可逆反应的正反应的限度大,正反应的速率就大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
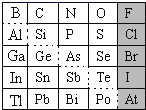
(1)根据元素周期律,推断:
①H3AsO4、H2SeO4的酸性强弱:H3AsO4___H2SeO4(填“>”、“<”或“=”)。
②氢化物的还原性:H2O___H2S(填“>”、“<”或“=”)。
(2)可在图中分界线(虚线部分)附近寻找___(填序号)。
A.优良的催化剂B.半导体材料C.合金材料D.农药
(3)①Se2Cl2常用作分析试剂,其电子式为___。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是___(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(4)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
实验步骤 | 实验现象与结论 |
在试管中加入___,再加入___,将生成气体通过___洗气后,通入___; | 现象:___;结论:非金属性C>Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com