
【题目】如图装置中,在U形管底部盛有CCl4 , 分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是( ) 
A.铁丝在两处的腐蚀速率:a<b
B.a、b两处相同的电极反应式为Fe﹣2e﹣=Fe2+
C.一段时间后,a处液面高于b处液面
D.生铁丝中的碳在a、b两处分别作原电池的负极和正极
【答案】D
【解析】解:生铁和氯化钠溶液、稀硫酸溶液都能构成原电池,左边试管中,生铁发生吸氧腐蚀,右边试管中,生铁发生析氢腐蚀,A.生铁发生析氢腐蚀的速率比吸氧腐蚀的速率大,故A正确;
B.a处负极上铁失电子,正极上氧气得电子,b处负极上铁失电子,正极上氢离子得电子,所以a、b两处相同的电极反应式为Fe﹣2e﹣=Fe2+ , 故B正确;
C.a处发生吸氧腐蚀,b处发生析氢腐蚀,一段时间后,a处气体压强减小,b处气体压强增大,导致溶液从b处向a处移动,所以a处液面高于b处液面,故C正确;
D.生铁中的碳在a、b两处都作正极,故D错误;
故选D.
生铁中含有碳、铁,生铁遇到合适的电解质溶液能构成原电池,酸性条件下,发生析氢腐蚀,中性或弱酸性条件下,发生吸氧腐蚀,据此分析解答.


科目:高中化学 来源: 题型:
【题目】按下列实验方法制备气体,合理而又实用的是( )
A.锌粒与稀硝酸反应制备H2
B.将饱和氨水滴加到新制的生石灰制NH3
C.亚硫酸钠与稀硫酸反应制备SO2
D.大理石与浓硫酸反应制备CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCl4和蒸馏水都是无色液体,请按下列要求用实验方法鉴别:
(1)只允许用一种试剂:用两支试管分别取出少量的CCl4和蒸馏水,然后分别加入少量的单质碘,振荡,呈紫红色的液体是__________,呈棕黄色的液体是__________。
(2)不用任何试剂:用试管取出少量的其中一种液体,再加入另外一种液体,下层液体是__________,上层液体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置用于实验室制取氨气并检验氨气的某一化学性质,其中能达到实验目的是( )
A.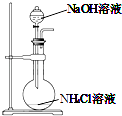 用装置图制取氨气
用装置图制取氨气
B.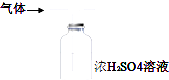 用装置图除去氨气中的水蒸气
用装置图除去氨气中的水蒸气
C.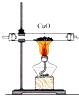 用装置图验证氨气具有还原性
用装置图验证氨气具有还原性
D.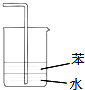 用装置图吸收氨气
用装置图吸收氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下面实验:
(1)准确量取25.00mL高锰酸钾溶液,可选用的仪器是 .
(A)50mL量筒 (B)10mL量筒 (C)50mL酸式滴定管 (D)50mL碱式滴定管
(2)进行中和滴定时,事先不应该用所盛溶液润洗的仪器是 .
(A)酸式滴定管 (B)碱式滴定管 (C)锥形瓶 (D)量筒
(3)某烧碱样品中含有少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
(A)在250mL的容量瓶中定容配制250mL烧碱溶液;
(B)用移液管移取25mL烧碱溶液于锥形瓶中,并滴入几滴甲基橙作指示剂;
(C)在托盘天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解;
(D)将物质的量浓度为cmolL﹣1的标准硫酸溶液装入已润洗过的酸式滴定管中,调整液面并记下起始读数为V1mL;
(E)在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数为V2mL.
就此完成下列问题:
①正确操作步骤是(用编号字母填空)→→→D→;
②观察滴定管里液面的高度时应注意: .
③E步骤的操作中在锥形瓶下垫一张白纸的作用是 .
④D步骤的操作中液面应调整到 , 尖嘴部分应该 .
⑤某学生实验时把锥形瓶用待测烧碱溶液润洗,则测定的烧碱溶液的浓度偏高还是偏低;
⑥该烧碱样品纯度的计算公式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲和乙的某些性质如下表所示:
物质 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 水中的溶解性 |
甲 | -98 | 37.5 | 0.93 | 可溶 |
乙 | -48 | 95 | 0.90 | 可溶 |
现有甲和乙的混合物,进行分离时,可采用的方法是( )
A. 蒸发B. 过滤C. 蒸馏D. 萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质分类不正确的是( )
选项 | A | B | C | D |
物质 | 液氧、空气、Cl2、铜丝 | HCl、H2SO4、H2O、HNO3 | NaCl溶液、盐酸、CuSO4·5H2O | NH3、NaOH、BaSO4固体 |
分类标准 | 单质 | 酸 | 混合物 | 电解质 |
不属于该 类的物质 | 空气 | H2O | 盐酸 | NH3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况).向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
A.该浓硝酸中HNO3的物质的量浓度是12.0 mol/L
B.该合金中铜与镁的物质的量之比是2:1
C.NO2和N2O4的混合气体中,N2O4的体积分数是20%
D.得到2.54g沉淀时,加入NaOH溶液的体积是6.0 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 Q、R、T、W 在元素周期表中的位置如图所示,其中T 所处的周期序数与主族序数相等,请回答下列问题:
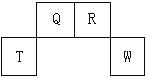
(1)W 在周期表中的位置是____________, Q、R、T 三种元素原子的半径从大 到小排列顺序_____________ (用元素符号表示),Q 的最高价氧化物的电子 式________________,R 气态氢化物分子的结构式为_______________。
(2)元素的原子得电子能力:Q________________W(填“强于”或“弱于”)。
(3)T、Q、R、W 的单质中,固态时属于原子晶体的是______________(填名称)。
(4)现有 8 种元素的性质、数据如下表所列,它们属于短周期:请指出 R 元素在下表中的对应编 号__________________ ,与 T 同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编 号_____________。
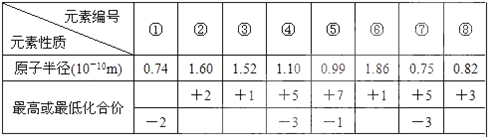
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com