
【题目】短周期元素 Q、R、T、W 在元素周期表中的位置如图所示,其中T 所处的周期序数与主族序数相等,请回答下列问题:
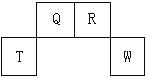
(1)W 在周期表中的位置是____________, Q、R、T 三种元素原子的半径从大 到小排列顺序_____________ (用元素符号表示),Q 的最高价氧化物的电子 式________________,R 气态氢化物分子的结构式为_______________。
(2)元素的原子得电子能力:Q________________W(填“强于”或“弱于”)。
(3)T、Q、R、W 的单质中,固态时属于原子晶体的是______________(填名称)。
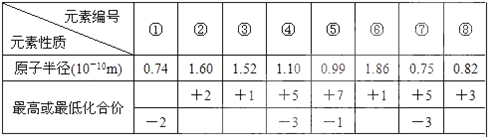
(4)现有 8 种元素的性质、数据如下表所列,它们属于短周期:请指出 R 元素在下表中的对应编 号__________________ ,与 T 同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编 号_____________。
【答案】 第 3 周期ⅥA 族 Al>C>N ![]()
![]() 弱于 金刚石 ⑦ ⑥
弱于 金刚石 ⑦ ⑥
【解析】试题分析:T 所处的周期序数与主族序数相等,所以T是第3周期、第ⅢA族元素, T是Al元素,则Q、R、W分别是C、N、S元素。根据表格数据,①的化合价为-2,①是O元素;⑤的化合价是+7、-1,所以⑤是Cl元素;④⑦的化合价都是+5、-3,半径④>⑦,所以④是P元素、⑦是N元素;③⑥的化合价都是+1,根据半径,③⑥不可能是H元素,半径③<⑥,所以③是Li元素、⑥是Na元素;②的化合价为+2,半径大于锂,所以②是Mg元素;⑧的化合价为+3,半径小于P,所以⑧是B元素;
解析:根据以上分析,(1)W 是S元素,在周期表中的位置是第 3 周期ⅥA 族,Al、C、N 三种元素原子,Al电子层数最多,半径最大,C、N电子层数相同,C的质子数少,半径大,所以半径从大 到小排列顺序Al>C>N,C的最高价氧化物是CO2,CO2是共价化合物,电子式是 ![]() ,N气态氢化物是氨气,分子的结构式为
,N气态氢化物是氨气,分子的结构式为![]() 。
。
(2)S的非金属性大于C元素,所以原子得电子能力:C弱于S。
(3)Al、C、N、S 的单质中,金刚石属于原子晶体。
(4)根据分析, R 是N元素,表中⑦是N元素,所以R对应编号是⑦, T 是是第3周期元素,同周期元素中最高价氧化物的水化物碱性最强的是氢氧化钠,钠元素对应的编号是⑥。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】如图装置中,在U形管底部盛有CCl4 , 分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是( ) 
A.铁丝在两处的腐蚀速率:a<b
B.a、b两处相同的电极反应式为Fe﹣2e﹣=Fe2+
C.一段时间后,a处液面高于b处液面
D.生铁丝中的碳在a、b两处分别作原电池的负极和正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喹硫平可用于精神疾病的治疗,它的合成路线如下:
(1)A属于烃,相对分子式量为54,A的结构简式为
(2)反应①﹣﹣⑤中属于取代反应的有 , 反应⑦的化学方程式为
(3)流程中设计反应⑤和⑦的目的是
(4)物质C的同分异构体中,既含有羟基,又含有醛基的同分异构体有种
(5)已知:苯环上的羧基为间位定位基,如 ![]() 写出以甲苯为原料制备
写出以甲苯为原料制备  的合成路线 .
的合成路线 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A. 过滤操作时,漏斗下部的尖嘴要紧靠烧杯的内壁
B. 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干
C. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
D. 使用容量瓶时,要先干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)Si(s)+4HCl(g);△H=+Q kJmol﹣1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应4 min时,若HCl浓度为0.12 molL﹣1 , 则H2反应速率为0.03 molL﹣1min﹣1
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 molL﹣1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.制备铜氨纤维时,取出稀盐酸中的生成物,用水洗涤,得到蓝色的铜氨纤维
B.天然气的主要成分是甲烷,不同地区天然气中甲烷含量不同
C.长久存放的氯水逐渐转变为很稀的盐酸
D.在燃烧木柴时,将木材架空,木材会燃烧的更旺
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向饱和的氢氧化钠溶液中加入少量的过氧化钠,充分反应后,恢复原来的温度,下列说法正确的是
A. 溶液中![]() 浓度增大,有
浓度增大,有![]() 放出 B. 溶液pH不变,有固体析出,有
放出 B. 溶液pH不变,有固体析出,有![]() 放出
放出
C. 溶液中![]() 数目增多,有
数目增多,有![]() 放出 D. 溶液中
放出 D. 溶液中![]() 数目不变,有
数目不变,有![]() 放出
放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是重要的氧化剂,铁、铜是生活中常见的金属.
(1)Fe与Cu混合物与65%的硝酸反应会产生大量NO2 , 该反应使用的硝酸的物质的量浓度为mol/L(已知ρ=1.4g/cm3).
(2)各为0.1mol的Cu与Fe混合物与足量的某浓度的硝酸反应产生4.48L气体(标准状况下),则该反应消耗的硝酸为mol.
(3)4.4gFe与Cu混合物与过量的硝酸反应,放出的气体与标准状况下的1.12L的氧气混合后通入水中恰好被完全吸收,则其中铜的质量为g.
(4)Fe与Cu混合物共有a mol,其中铜的物质的量分数为X,将该混合物全部投入b mol的硝酸中使其充分反应,假定硝酸的还原产物仅有NO,①若溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法合理的是( )
A.可用水鉴别己烷、四氯化碳、乙醇三种无色液体
B.油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离
C.可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量必须相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com