我国政府承诺,到2020年,单位GDP二氧化碳排放量比2005年下降40%~50%.
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
(填序号).
a.电解水制氢:2H
2O
2H
2↑+O
2↑
b.高温使水分解制氢:2H
2O(g)
2H
2+O
2c.太阳光催化分解水制氢:2H
2O
2H
2↑+O
2↑
d.天然气制氢:CH
4+H
2O(g)
CO+3H
2(2)CO
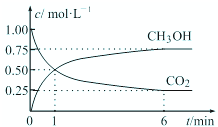
2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO
2和3mol H
2,一定条件下反应:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g),测得CO
2和CH
3OH(g)浓度随时间变化如图所示.
①从1min到6min,υ(H
2)=
mol?L
-1?min
-1.
②能说明上述反应达到平衡状态的是
(填编号).
a.总压强保持不变
b.混合气体的密度不随时间的变化而变化
c.H
2的体积分数在混合气体中保持不变
d.单位时间内消耗3mol H
2,同时生成1mol H
2O
e.反应中CO
2与H
2的物质的量之比为1:3保持不变
(3)工业上,也可用CO和H
2在5MPa和250℃的条件下合成CH
3OH.参考下表中合成反应CO(g)+2H
2(g)?CH
3OH(g)在不同温度下的平衡常数:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
下列说法正确的是
.
a.该反应正反应是吸热反应,且△S<0
b.该反应达到平衡后,增大压强,CO的转化率升高
c.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H
2,若达到平衡时CO转化率为50%,则此时的平衡常数为10
d.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下原料气转化率最高.

 我国政府承诺,到2020年,单位GDP二氧化碳排放量比2005年下降40%~50%.
我国政府承诺,到2020年,单位GDP二氧化碳排放量比2005年下降40%~50%.

 中考解读考点精练系列答案
中考解读考点精练系列答案
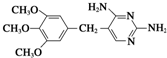 的副产物,为了使该产物的含量降到最低,需要合成路线中第
的副产物,为了使该产物的含量降到最低,需要合成路线中第 .化合物
.化合物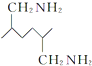 是合成染料的中间体,请写出以氯乙烷为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH
是合成染料的中间体,请写出以氯乙烷为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH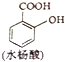 )分子式相同,并且分子中含有6个碳原子在一条直线上,分子中所有官能团包括水杨酸具有的含氧官能团的有机物是( )
)分子式相同,并且分子中含有6个碳原子在一条直线上,分子中所有官能团包括水杨酸具有的含氧官能团的有机物是( )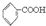 >H2CO3>
>H2CO3> >HCO3-将
>HCO3-将 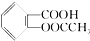 转变为
转变为 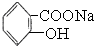 ,可行的方法是( )
,可行的方法是( )