
| 分类标准 | 能导电的物质 | 电解质 | 非电解质 |
| 属于该类的物质 |
| ②⑦⑧⑨⑩ | ①③⑤⑥⑩ | ④ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
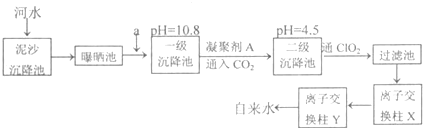
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
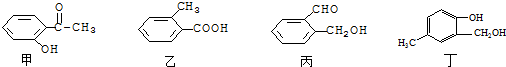
查看答案和解析>>
科目:高中化学 来源: 题型:
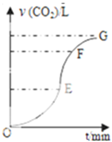 用纯净CaCO3与稀盐酸反应制取二氧化碳气体,产生气体的体积随时间的变化曲线如图所示请回答:(气体体积均在标准状况下测定).
用纯净CaCO3与稀盐酸反应制取二氧化碳气体,产生气体的体积随时间的变化曲线如图所示请回答:(气体体积均在标准状况下测定).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 表示的分子式是
表示的分子式是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5L 0.1mol/L的NaCl溶液 |
| B、100mL 0.2mol/L的MgCl2溶液 |
| C、50mL 0.2mol/L的AlCl3溶液 |
| D、1L 0.5mol/L盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯碱和烧碱都属于碱 |
| B、氨水能导电,所以NH3是电解质 |
| C、强电解质水溶液的导电性不一定比弱电解质的水溶液导电性强 |
| D、凡是能电离出H+的化合物都叫做酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
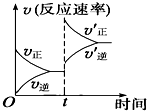 制取水煤气的反应为C(s)+H2O(g)?CO(g)+H2(g)△H>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )
制取水煤气的反应为C(s)+H2O(g)?CO(g)+H2(g)△H>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )| A、加压 | B、升温 |
| C、增大水蒸气浓度 | D、增大碳的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com