
硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4•7H2O的流程如下。
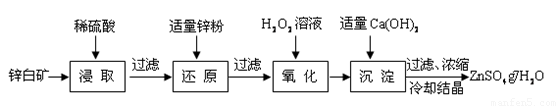
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
(1)浸取过程中提高浸出效率可采用的措施有 (任答一条),
ZnO和硫酸反应的化学方程式为 。
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;② 。
(3)氧化过程中H2O2发生反应的离子方程式为 。
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式
K= ,Ca(OH)2不能过量的原因是 。
(12分)
(1)将矿石粉碎或提高浸取温度或适当增加酸的浓度等(2分)
ZnO+H2SO4=ZnSO4+H2O(2分)
(2)除去Cu2+(2分)
(3)H2O2+2Fe2++2H+=2Fe3++2H2O(2分)
(4)c3(H+)/c(Fe3+) (2分) 防止生成Zn(OH)2(2分)
【解析】
试题分析:(1)浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸锌的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率,故答案为:适当提高反应温度、增加浸出时间(或其他合理答案);ZnO和硫酸反应的化学方程式为ZnO+H2SO4=ZnSO4+H2O,故答案为: ZnO+H2SO4=ZnSO4+H2O;⑵加入锌粉,发生以下反应:Zn+2H+=Zn2++H2↑,Zn+2Fe3+=2Fe2++Zn2+ ,Fe+Cu2+ =Cu+Zn2+ ,Zn过量后:Fe2++Zn=Fe+Zn2+ ,所以题目中加入适量的锌粉,②除去Cu2+ ,答案:除去Cu2+;⑶H2O2将Fe2+ 氧化成Fe3+ 便于在pH较低的条件下,利用水解除去Fe3+ ,答案:H2O2+2Fe2++2H+=2Fe3++2H2O;⑷根据水解方程式Fe3++3H2O Fe(OH)3+3H+ ,写出平衡常数K= c3(H+)/c(Fe3+) ;Ca(OH)2不能过量的原因是:Fe3+ 在pH为1.1―3.2时沉淀,pH在5.9―8.9时Zn2+ 沉淀,答案:c3(H+)/c(Fe3+);防止生成Zn(OH)2。
Fe(OH)3+3H+ ,写出平衡常数K= c3(H+)/c(Fe3+) ;Ca(OH)2不能过量的原因是:Fe3+ 在pH为1.1―3.2时沉淀,pH在5.9―8.9时Zn2+ 沉淀,答案:c3(H+)/c(Fe3+);防止生成Zn(OH)2。
考点:元素化合物知识与生产工艺、化学平衡原理结合


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:

| c3(H+) |
| c(Fe3+) |
| c3(H+) |
| c(Fe3+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com