
| A. | BaCl2溶液与稀H2SO4溶液的反应:Ba2++2Cl-+2H++SO42-═BaSO4↓+2HCl | |
| B. | NaHCO3与NaOH溶液反应:HCO3-+OH-═CO2↑+H2O | |
| C. | 用KSCN检验Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | 盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH-═SiO32-+H2O |
分析 A.氯化氢为强电解质,应拆成离子形式;
B.不符合反应客观事实;
C.Fe(SCN)3不是沉淀;
D.二者反应生成硅酸钠和水.
解答 解:A.BaCl2溶液与稀H2SO4溶液的反应,离子方程式:Ba2++SO42-═BaSO4↓,故A错误;
B.NaHCO3与NaOH溶液反应,离子方程式:HCO3-+OH-═CO32-+H2O,故B错误;
C.用KSCN检验Fe3+,离子方程式:Fe3++3SCN-═Fe(SCN)3,故C错误;
D.盛放碱性试剂的溶液不能用玻璃塞的原因,离子方程式:SiO2+2OH-═SiO32-+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式的书写解题关键,题目难度不大.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:解答题
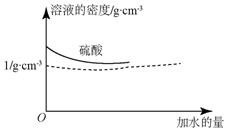 已知硫酸的密度与所加水量的关系如图所示,
已知硫酸的密度与所加水量的关系如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:推断题
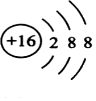 .
.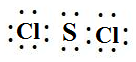 ,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.
,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.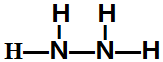 .常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.
.常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
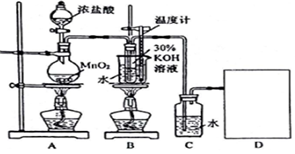
| 实验 编号 | 试剂及其用量 | |||
| 0.2mol•L-1kJ/mL | KClO3(s)/g | 6.0mol•L-1H2SO4/mL | H2O/mL | |
| 1 | 1.0 | 0.1 | 0 | a |
| 2 | 1.0 | 0.1 | 3.0 | b |
| 3 | 1.0 | 0.1 | 6.0 | c |
| 4 | 1.0 | 0.1 | 9.0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 松油醇的结构简式为 ,则其同分异构体可能属于醛类、酮类或芳醇类 ,则其同分异构体可能属于醛类、酮类或芳醇类 | |
| B. | 甲烷和氯气的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 分子式为C4H8O2且能与氢氧化钠溶液反应的有机物(不考虑立体异构和醛类物质)有6种 | |
| D. | 乙醇、乙酸均能与NaOH溶液反应,因为分子中均含有-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
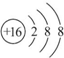 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
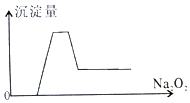 有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )
有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )| A. | ①②③④⑦ | B. | ①③④⑦ | C. | ①②③⑤⑦ | D. | ①③④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯银物品久置表面变暗 | |
| B. | 生铁(含有碳等杂质)比纯铁在潮湿的环境中容易生锈 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com