
| 实验 编号 | 试剂及其用量 | |||
| 0.2mol•L-1kJ/mL | KClO3(s)/g | 6.0mol•L-1H2SO4/mL | H2O/mL | |
| 1 | 1.0 | 0.1 | 0 | a |
| 2 | 1.0 | 0.1 | 3.0 | b |
| 3 | 1.0 | 0.1 | 6.0 | c |
| 4 | 1.0 | 0.1 | 9.0 | 0 |
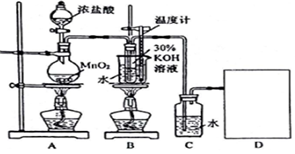
分析 (1)氯气有毒,过量的氯气不能直接排放到空气中应进行尾气处理,结合氯气能够与氢氧化钠反应,被氢氧化钠溶液吸收画出尾气处理装置;
二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;依据方程式可知2Cl-~Cl2~2e-,据此当产生2.24mL(标准状况)Cl2时,转移电子数目;
(2)氯气与氢氧化钾在加热条件下发生歧化反应生成氯化钾和氯酸钾、水;实验室用二氧化锰和浓盐酸来制取氯气,制得的氯气中含有氯化氢,HCl极易溶于水,能和KOH反应生成KCl杂质;
(3)从高温的氯酸钾溶液中得到氯酸钾晶体,需要经过冷却结晶、过滤、洗涤、干燥;
①氯气与水反应生成盐酸与次氯酸,盐酸具有酸性,次氯酸具有漂白性,据此判断现象;
②氯水中氯气、HClO、氯离子、次氯酸根离子都含有氯离子,将氧化性微粒物质还原成Cl-,再利用生成AgCl沉淀的质量测定氯水中氯元素总量,选择H2O2为还原剂;
(4)依据盐类水解的规律:越弱越水解设计实验;
(5)依据表格中数据:碘化钾物质的量、氯酸钾的质量相等,可知该实验目的比较硫酸浓度对反应产物的影响,则应保证溶液体积相等,碘化钾、氯酸钾的浓度相等,据此确定a值;碘遇到淀粉变蓝,此系列实验中加入淀粉能够使现象更明显.
解答 解:(1)氯气有毒,不能直接排放到空气中,能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收氯气,装置图为: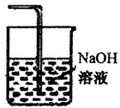 ;
;
故答案为: ;
;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,依据方程式可知2Cl-~Cl2~2e-,
当产生2.24mL(标准状况)Cl2时物质的量为:$\frac{2.24×1{0}^{-3}L}{22.4L/mol}$=10-4mol,转移电子数为:10-4mol×6.02×1023mol-1=1.204×1022;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;1.204×1022;
氯气与氢氧化钾在加热条件下发生歧化反应生成氯化钾和氯酸钾、水,离子方程式:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O;实验室用二氧化锰和浓盐酸来制取氯气,制得的氯气中含有氯化氢,HCl极易溶于水,能和KOH反应生成KCl杂质,若对调B和C装置,可以除去氯化氢杂质,能提高B中氯酸钾的产率;
故答案为:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O;提高氯酸钾的纯度;
(3)从高温的氯酸钾溶液中得到氯酸钾晶体,需要经过冷却结晶、过滤、洗涤、干燥;
故答案为:冷却结晶;
①氯气与水反应生成盐酸与次氯酸,盐酸具有酸性,次氯酸具有漂白性,所以滴入石蕊后,溶液先变红后褪色;
故答案为:先变红后褪色;
②氯水中氯气、HClO、氯离子、次氯酸根离子都含有氯离子,将氧化性微粒物质还原成Cl-,再利用生成AgCl沉淀的质量测定氯水中氯元素总量,选择H2O2为还原剂,将氯气、次氯酸、次氯酸根离子还原为氯离子;
故答案为:将氯气、次氯酸、次氯酸根离子还原为氯离子;
(4)欲证明相同条件下HClO的电离常数大于HCO3-,分别测同温度物质的量浓度的次氯酸钠和碳酸氢钠溶液的pH,依据越弱越水解规律,对应钠盐的pH值越大,则其对应酸越弱,电离常数越小;
故答案为:分别测同温度物质的量浓度的次氯酸钠和碳酸氢钠溶液的pH;
(5)依据表格中数据:碘化钾物质的量、氯酸钾的质量相等,可知该实验目的比较硫酸浓度对反应产物的影响,则应保证溶液体积相等,碘化钾、氯酸钾的浓度相等,依据数据4可知,溶液总体积为10mL,则a为9.0mL;碘遇到淀粉变蓝,此系列实验中加入淀粉能够使现象更明显;
故答案为:9.0;淀粉溶液.
点评 本题为实验题以氯水、氯酸钾的制备为载体考查氯及其化合物的性质,侧重考查化学仪器的使用、实验方案的设计与评价、离子方程式的书写等知识,掌握实验室制取氯气原理,明确氯气、氯水的性质是解答的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ H+ NO3- Fe2+ | B. | Ca2+ H+ ClO- NO3- | ||
| C. | K+ H+ Cl- SO42- | D. | Fe3+ Cl- H+ CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
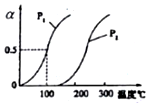 甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.| 实验编号 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| ⅰ | 150 | $\frac{1}{3}$ | 0.1 |
| ⅱ | 150 | $\frac{1}{3}$ | 5 |
| ⅲ | 350 | $\frac{1}{3}$ | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 操作方法 | 原理 |
| A | 验证淀粉水解产物是否具有还原性 | 取水解液于试管中加入新制氢氧化铜悬浊液,加热煮沸 | 水解产物为葡萄糖,与新制氢氧化铜悬浊液共热出现砖红色沉淀 |
| B | 除去溴苯中的溴 | 将混合物倒入分液漏斗中,加入苯,充分振荡,静置,分液 | 溴易溶于苯 |
| C | 制备氢氧化铁胶体 | 在氢氧化钠溶液中加入饱和FeCl3溶液,煮沸 | 加入NaOH促进FeCl3溶液水解,从而得到氢氧化铁胶体 |
| D | 验证CH3COONa溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(水溶液呈中性),观察溶液颜色变化 | 加入醋酸铵固体,使CH3COONa溶液水解平衡逆向移动,颜色变浅 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液与稀H2SO4溶液的反应:Ba2++2Cl-+2H++SO42-═BaSO4↓+2HCl | |
| B. | NaHCO3与NaOH溶液反应:HCO3-+OH-═CO2↑+H2O | |
| C. | 用KSCN检验Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | 盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者的分子个数之比为16:17 | |
| B. | 二者的原子个数之比为17:16 | |
| C. | 二者的氢原子个数之比为17:12 | |
| D. | 同温同压下两种气体的体积之比为16:17 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
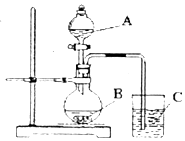 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com