
【题目】近年来,莽草酸作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图所示:
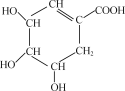 。
。
(1)莽草酸中含氧官能团有羟基和________(填名称)。
(2)莽草酸的分子式为________。
(3)向莽草酸溶液中滴入2~3滴紫色石蕊试液,现象为________。
(4)1 mol莽草酸在一定条件下和H2发生加成反应,最多消耗________mol H2。
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】硼(B)及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠(NaBH4)是硼的重要化合物。
①NaBH4中B元素的化合价为___。
![]() 工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为___。NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为___。
工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为___。NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为___。
(2)工业上以铁硼矿(主要成分为Mg2B2O5·H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备单质B的工艺流程如图所示:
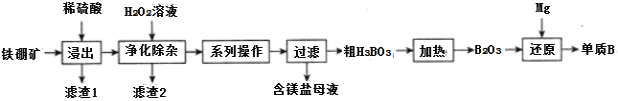
已知:
金属离子 | Fe3+ | Al3+ |
开始沉淀的PH | 2.7 | 3.1 |
沉淀完全的PH | 3.7 | 4.9 |
![]() “浸出”时,将铁硼矿石粉碎的目的为___。
“浸出”时,将铁硼矿石粉碎的目的为___。
![]() 滤渣1的主要成分为___。
滤渣1的主要成分为___。
![]() “净化除杂”时需先加H2O2溶液,其目的为___,然后再调节溶液的pH≈5.0的目的是___。
“净化除杂”时需先加H2O2溶液,其目的为___,然后再调节溶液的pH≈5.0的目的是___。
![]() 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用___(填“酸式”或“碱式”)滴定管,该粗硼样品的纯度为___。
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用___(填“酸式”或“碱式”)滴定管,该粗硼样品的纯度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可采用电化学方法除去代谢产物中的尿素,其原理如图所示。
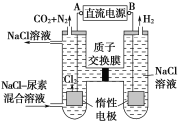
(1)电源的负极为__(填“A”或“B”)。
(2)阳极室中发生的反应依次为__、__。
(3)电解结束后,阴极室中溶液的pH与电解前相比将__(填“升高”“降低”或“不变”);若两极共收集到气体13.44L(标准状况下),则除去的尿素为__g(忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如下图所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应I CO2(g)+4H2(g) CH4(g) + 2H2O(g) △H1
反应II CO2(g) + H2(g) CO(g) + H2O(g) △H2
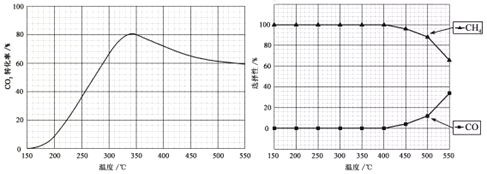
下列说法不正确的是
A.△H1小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可采用丙烯氨氧化法制丙烯脂,回答下列问题:
I.丙烯的制备反应方程式为C3H8(g)=C3H6(g)+H2(g)。
已知:部分共价键的键能如下:
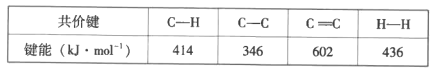
(1)制备丙烯反应的△H=__。该反应在__(“高温”或“低温”)下有利于自发进行。
(2)提高丙烯产率可以选择__(填序号)。
A.升温 B.减小压强 C.充入H2(恒容) D.加入催化剂
(3)已知:CO2(g)+H2(g)=CO(g)+H2O(g) H=-41kJ·mol-1,工业上选择向反应体系中加入CO2,提高丙烷的转化率,从化学平衡原理角度说明原因:__。
II.利用丙烯制备丙烯腈,反应方程式如下:2C3H6(g)+2NH3(g)+3O2(g)![]() 2CH2=CHCN(g)+6H2O(l) H=-1294kJ·mol-1。
2CH2=CHCN(g)+6H2O(l) H=-1294kJ·mol-1。
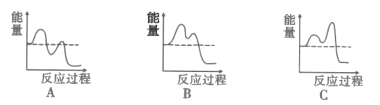
(4)主要的反应机理如下:
CH3-CH=CH2→[CH2![]() CH
CH![]() CH2]+H 慢 H>0
CH2]+H 慢 H>0
[CH2![]() CH
CH![]() CH2]+[NH]→CH2=CH-CN+3H 快
CH2]+[NH]→CH2=CH-CN+3H 快
如图能表示反应历程的是__(填序号)。.
(5)一定温度下,IL恒容密闭容器中充人等物质的量的C3H6、NH3、O2制备丙烯腈,c(C3H6)与v正随时间变化的数据如下表:
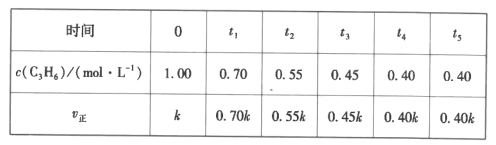
①判断t4时刻反应是否已经达到平衡状态并说明理由:__。
②列式并计算制备丙烯腈反应的平衡常数K=__(mol·L-1)-5。
③已知:正反应速率v正=kca(C3H6),根据表中数据,a=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.由13 g乙酸与2 g CO(NH2)2(尿素)形成的混合物中含有的氢原子总数为NA
B.标准状况下,体积均为2.24 L的CH4与H2O含有的电子总数均为NA
C.2 mol NO与1 mol O2在密闭容器中充分反应,产物的分子数为2NA
D.向1 L 1 mol·L-1 NaClO溶液中通入足量CO2,溶液中HClO的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工发展水平。请回答下列问题。
(1)乙烯的电子式为____,结构简式为____。
(2)鉴别甲烷和乙烯可用的试剂是____(填字母)。
A 稀硫酸 B 溴的四氯化碳溶液
C 水 D 酸性高锰酸钾溶液
(3)已知2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。
乙烯![]() A
A![]() B
B![]() 乙酸
乙酸
反应②的化学方程式为________。
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为____,反应类型是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com