
【题目】工业上可采用丙烯氨氧化法制丙烯脂,回答下列问题:
I.丙烯的制备反应方程式为C3H8(g)=C3H6(g)+H2(g)。
已知:部分共价键的键能如下:
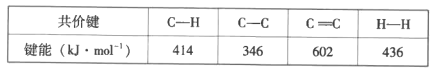
(1)制备丙烯反应的△H=__。该反应在__(“高温”或“低温”)下有利于自发进行。
(2)提高丙烯产率可以选择__(填序号)。
A.升温 B.减小压强 C.充入H2(恒容) D.加入催化剂
(3)已知:CO2(g)+H2(g)=CO(g)+H2O(g) H=-41kJ·mol-1,工业上选择向反应体系中加入CO2,提高丙烷的转化率,从化学平衡原理角度说明原因:__。
II.利用丙烯制备丙烯腈,反应方程式如下:2C3H6(g)+2NH3(g)+3O2(g)![]() 2CH2=CHCN(g)+6H2O(l) H=-1294kJ·mol-1。
2CH2=CHCN(g)+6H2O(l) H=-1294kJ·mol-1。
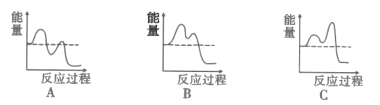
(4)主要的反应机理如下:
CH3-CH=CH2→[CH2![]() CH
CH![]() CH2]+H 慢 H>0
CH2]+H 慢 H>0
[CH2![]() CH
CH![]() CH2]+[NH]→CH2=CH-CN+3H 快
CH2]+[NH]→CH2=CH-CN+3H 快
如图能表示反应历程的是__(填序号)。.
(5)一定温度下,IL恒容密闭容器中充人等物质的量的C3H6、NH3、O2制备丙烯腈,c(C3H6)与v正随时间变化的数据如下表:
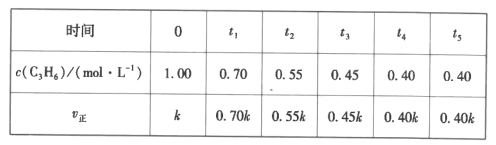
①判断t4时刻反应是否已经达到平衡状态并说明理由:__。
②列式并计算制备丙烯腈反应的平衡常数K=__(mol·L-1)-5。
③已知:正反应速率v正=kca(C3H6),根据表中数据,a=__。
【答案】+136 kJ/mol 高温 AB CO2与H2反应,降低H2的浓度,使C3H6的制备反应平衡正向移动,CO2与H2的反应是放热反应,使反应体系温度升高,C3H6的制备反应平衡正向移动 B t4时刻,正反应速率和C3H6的浓度均不再变化,则反应达到平衡 ![]() =
=![]() 1.41
1.41![]() 104 1
104 1
【解析】
Ⅰ.(1)根据键能计算可得;反应是吸热反应,且是熵增,根据△G=△H-T△S分析;
(2)反应吸热且气体分子数增加,提高丙烯产率需使平衡正向移动;
(3)体系中加入CO2使CO2(g)+H2(g)=CO(g)+H2O(g)正向移动,影响了H2浓度和体系温度,从这两方面进行分析;
Ⅱ.(4)第一步反应吸热,第二步放热,第一步反应慢,则活化能高;
(5)①观察反应速率,速率不变或浓度不变则达到了平衡,因此,t4时刻达到平衡
②根据“三段式”法进行计算;
③根据数据可知,v正是关于c(C3H6)的一次函数。
Ⅰ.(1)1个C3H8分子中有2个C-C键和8个C-H键,1个C3H6分子中有1个C-C键、1个C=C键和6个C-H键,1个H2分子中有1个H-H键,则制备丙烯反应的△H=(2![]() 346+8
346+8![]() 414-346-6
414-346-6![]() 414-602-436)kJ/mol=+136 kJ/mol;反应是吸热反应,且是熵增,根据△G=△H-T△S,因此高温有利;
414-602-436)kJ/mol=+136 kJ/mol;反应是吸热反应,且是熵增,根据△G=△H-T△S,因此高温有利;
(2)反应吸热且气体分子数增加,升温和减小压强可以使平衡正向移动,冲入H2会使平衡逆向移动,加入催化剂平衡不移动,故选AB;
(3)CO2与H2反应,降低H2的浓度,使C3H6的制备反应平衡正向移动,CO2与H2的反应是放热反应,使反应体系温度升高,C3H6的制备反应平衡正向移动;
Ⅱ.(4)第一步反应吸热,第二步放热,排除A,第一步反应慢,则活化能高,故选B;
(5)①观察反应速率,速率不变或浓度不变则达到了平衡,因此,t4时刻达到平衡;
②由表中数据可得:

K=![]() 1.41
1.41![]() 104;
104;
③根据数据可知,v正是关于c(C3H6)的一次函数,则a=l。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】如图是进行Mg与SiO2反应的实验装置,O2和H2O(g)的存在对该实验有较大影响。

下列说法不正确的是
A.装稀硫酸仪器的名称是分液漏斗,II中洗气瓶内是碳酸氢钠溶液
B.可以把装置I换成启普发生器
C.实验开始时,必须先通一段时间X气体,再在III处加热
D.当III处反应引发后,移走酒精灯,反应仍进行,说明该反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学固氮可以在常温常压下实现氮气的还原合成氨,某课题组提出一种全新的电化学固氮机理——表面氢化机理示意图如下,则有关说法错误的是
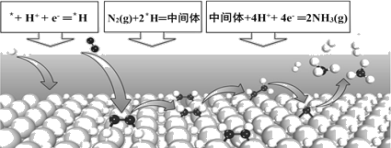
A.在表面氢化机理中,第一步是H+的还原反应
B.在表面*H原子与催化剂的协同作用下,N2与表面*H原子反应生成*N2H4中间体
C.电化学固氮法较传统工业合成氨法,具有能耗小、环境友好的优点
D.若竞争反应(析氢反应)的活化能显著低于固氮反应,则析氢反应的速率要远远高于固氮反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,莽草酸作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图所示:
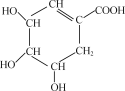 。
。
(1)莽草酸中含氧官能团有羟基和________(填名称)。
(2)莽草酸的分子式为________。
(3)向莽草酸溶液中滴入2~3滴紫色石蕊试液,现象为________。
(4)1 mol莽草酸在一定条件下和H2发生加成反应,最多消耗________mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向1L0.1mol·L-1MgCl2和MnCl2溶液中加入Na2CO3,固体(忽略体积变化),如图为加入Na2CO3的物质的量与-1gc(Mg2+)或-lgc(Mn2+)之间的关系,已知常温下Ksp(MgCO3)>Ksp(MnCO3),下列说法正确的是( )
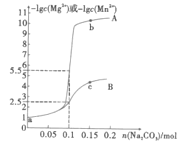
A.曲线A是n(Na2CO3)与-lgc(Mg2+)的关系曲线
B.Ksp(MnCO3)和Ksp(MgCO3)相差3个数量级
C.若将b点和c点溶液混合,存在![]() =1×106
=1×106
D.a点(MgCl2溶液)中存在:c(Mg2+)+c(H+)=c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质检验的实验结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 某溶液中加入氯化钡溶液 | 生成白色沉淀 | 该溶液一定含有SO42- |
B | 某溶液中加入无色酚酞试液 | 溶液变红色 | 该溶液一定是碱溶液 |
C | 将某溶液做焰色反应 | 焰色呈黄色 | 该溶液一定含有Na+ |
D | 往某溶液中加入盐酸 | 产生无色气体 | 该溶液一定含有CO32- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氮原子的最外层电子排布式是__;氮元素有多种化合价,列举一例含二种氮元素化合价的化合物__。
(2)肼(N2H4)分子可视为NH3分子的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。NH3分子的空间构型是__;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是__(化学式)。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)→3N2(g)+4H2O(g)+1038.7kJ,若该反应中有4molN-H键断裂,则形成的气体有__mol,其中转移电子数为__。
(4)肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__(填标号)
a.离子键 b.共价键 c.金属键 d.范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1 mol·L-1NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)=![]() ]如图所示:
]如图所示:
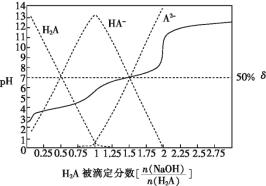
下列说法错误的是
A.用NaOH溶液滴定0.1 mol·L-1NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1Na2A溶液中:c(Na+)<c(HA-)+2c(A2-)
C.0.1 mol·L-1NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
D.H2A 的Ka2=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰及其化合物在工农业生产和科技领域具有广泛的应用。
Ⅰ.溶液中的Mn2+可被酸性(NH4)2S2O8溶液氧化为MnO4-,同时(NH4)2S2O8被还原为SO42-,该方法可用于检验Mn2+。
(1)用酸性(NH4)2S2O8溶液检验Mn2+时的实验现象为____。
(2)该反应的离子方程式为____。
(3)已知H2S2O8中硫的化合价为+6,若硫酸的结构简式为![]() ,则H2S2O8的结构简式为____。
,则H2S2O8的结构简式为____。
Ⅱ.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn的工艺流程如图所示。
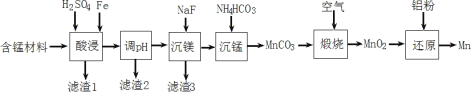
已知:①部分难溶物的溶度积常数如下表所示。
难溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
溶度积常数 | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
②当溶液中离子浓度≤1.0×10-5molL-1时,可认为该离子沉淀完全。
(1)“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为____;该过程中浸出时间和液固比对锰浸出率的影响分别如图所示。
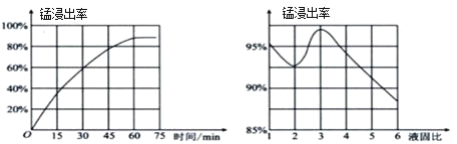
则适宜的浸出时间和液固比分别为____、____。
(2)若“酸浸”后所得滤液中c(Mn2+)=0.18molL-1,则应“调pH”的范围为____。
(3)“煅烧”反应中氧化剂与还原剂的物质的量之比为____。“还原”时发生的置换反应在化学上又叫作____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com