
【题目】(1)氮原子的最外层电子排布式是__;氮元素有多种化合价,列举一例含二种氮元素化合价的化合物__。
(2)肼(N2H4)分子可视为NH3分子的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。NH3分子的空间构型是__;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是__(化学式)。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)→3N2(g)+4H2O(g)+1038.7kJ,若该反应中有4molN-H键断裂,则形成的气体有__mol,其中转移电子数为__。
(4)肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__(填标号)
a.离子键 b.共价键 c.金属键 d.范德华力
【答案】2s22p3 NH4NO3或NH4NO2 三角锥形 C2H6 3.5 4NA cd
【解析】
(1)氮原子最外层有5个电子,2s能级上有2个电子,2p能级上有3个电子,所以其最外层电子排布式为2s22p3;N的化合价有多种,含有2种氮元素化合价的化合物,铵盐最有可能,如硝酸铵或亚硝酸铵中氮元素有两种化合价,故答案为:2s22p3;NH4NO3或NH4NO2;
(2)NH3分子中氮原子含有3个共价键和1个孤电子对,所以空间构型是三角锥型,与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是C2H6;
(3)若该反应中有4mol N-H键断裂,则有1molN2H4参加反应,生成气体的物质的量![]() mol=3.5mol,转移电子数=
mol=3.5mol,转移电子数=![]() ×1mol×NA·mol-1=4NA;
×1mol×NA·mol-1=4NA;
(4)硫酸铵是离子化合物,硫酸铵中存在离子键和共价键,N2H6SO4晶体类型与硫酸铵相同,所以N2H6SO4晶体内存在离子键和共价键,不含金属键和范德华力,故选cd。


科目:高中化学 来源: 题型:
【题目】磷矿石的主要成分是Ca5F(PO4)3,并含有少量MgO、Fe2O3等杂质。工业上以磷矿石为原料制备H3PO4,一种生产流程如下:

已知:Ca5F(PO4)3 + 7H3PO4→5Ca(H2PO4)2 + HF
38、写出有关操作的名称:Ⅰ___________、Ⅲ_________。工艺流程中设计操作Ⅱ与Ⅲ的目的是__________________________________。
39、若在实验室里采用此种方法溶解磷矿石,请写出必须的实验注意事项,并说明理由:_____________。
40、磷矿石也可直接用硫酸溶解,两种工艺相比,该工艺的优点是____________________。
41、测定产品磷酸的浓度可采用滴定法。准确量取10.00 mL磷酸产品(密度为1.526g/cm3)溶于水配成1L溶液;取稀释后的溶液20.00mL,以甲基橙为指示剂,用0.103 mol/L标准NaOH溶液滴定;当观察到溶液恰好变色,且在半分钟内不变色,即为滴定终点(生成NaH2PO4),消耗标准溶液20.16 mL。
该实验过程中需要的定量仪器有______________________________(写名称)。
42、若理论上滴定应耗用标准溶液20.20 mL,则相对误差为______________(按近似计算法则)。该产品中磷酸的质量分数为_____________(保留3位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如下图所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应I CO2(g)+4H2(g) CH4(g) + 2H2O(g) △H1
反应II CO2(g) + H2(g) CO(g) + H2O(g) △H2
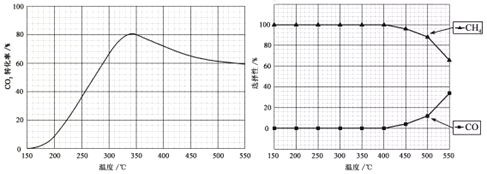
下列说法不正确的是
A.△H1小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可采用丙烯氨氧化法制丙烯脂,回答下列问题:
I.丙烯的制备反应方程式为C3H8(g)=C3H6(g)+H2(g)。
已知:部分共价键的键能如下:
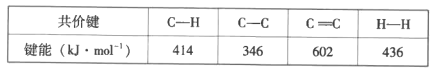
(1)制备丙烯反应的△H=__。该反应在__(“高温”或“低温”)下有利于自发进行。
(2)提高丙烯产率可以选择__(填序号)。
A.升温 B.减小压强 C.充入H2(恒容) D.加入催化剂
(3)已知:CO2(g)+H2(g)=CO(g)+H2O(g) H=-41kJ·mol-1,工业上选择向反应体系中加入CO2,提高丙烷的转化率,从化学平衡原理角度说明原因:__。
II.利用丙烯制备丙烯腈,反应方程式如下:2C3H6(g)+2NH3(g)+3O2(g)![]() 2CH2=CHCN(g)+6H2O(l) H=-1294kJ·mol-1。
2CH2=CHCN(g)+6H2O(l) H=-1294kJ·mol-1。
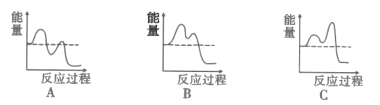
(4)主要的反应机理如下:
CH3-CH=CH2→[CH2![]() CH
CH![]() CH2]+H 慢 H>0
CH2]+H 慢 H>0
[CH2![]() CH
CH![]() CH2]+[NH]→CH2=CH-CN+3H 快
CH2]+[NH]→CH2=CH-CN+3H 快
如图能表示反应历程的是__(填序号)。.
(5)一定温度下,IL恒容密闭容器中充人等物质的量的C3H6、NH3、O2制备丙烯腈,c(C3H6)与v正随时间变化的数据如下表:
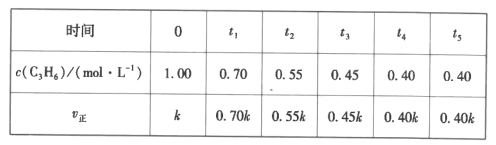
①判断t4时刻反应是否已经达到平衡状态并说明理由:__。
②列式并计算制备丙烯腈反应的平衡常数K=__(mol·L-1)-5。
③已知:正反应速率v正=kca(C3H6),根据表中数据,a=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示元素周期表中1~14周期的一部分,关于元素X、Y、Z、W的叙述错误的是( )
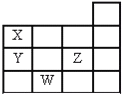
A.X、Y的最高价氧化物的水化物酸性为Y<X
B.Y、Z的气态氢化物的稳定性为Y<Z
C.Z有5种不同运动状态的电子
D.W的原子序数比Y大19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.由13 g乙酸与2 g CO(NH2)2(尿素)形成的混合物中含有的氢原子总数为NA
B.标准状况下,体积均为2.24 L的CH4与H2O含有的电子总数均为NA
C.2 mol NO与1 mol O2在密闭容器中充分反应,产物的分子数为2NA
D.向1 L 1 mol·L-1 NaClO溶液中通入足量CO2,溶液中HClO的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,常用作水果催熟剂,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示。

已知:醛可氧化生成羧酸。回答下列问题:
(1)写出下列物质的结构简式:A___;E___。
(2)写出下列反应的化学方程式,并注明反应类型:
①___、___;
②___、___;
④___、___;
(3)若想将B直接转化为D,可加入的物质为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,![]() 中所含中子数为
中所含中子数为![]()
B.![]() 溶液中含有
溶液中含有![]() 数目小于
数目小于![]()
C.熔融状态下,![]() 中所含阳离子数目为2
中所含阳离子数目为2![]()
D.25°C时,![]() 的碳酸钠溶液中,由水电离出的
的碳酸钠溶液中,由水电离出的![]() 数目为
数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是(假设金属的摩尔质量为Mg·mol-1金属原子半径为r cm,用NA表示阿伏加德罗常数的值)

A.金属Zn采用②堆积方式
B.①和③中原子的配位数分别为:6、8
C.对于采用②堆积方式的金属的晶胞质量为![]()
D.金属锻压时,会破坏密堆积的排列方式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com