
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,![]() 中所含中子数为
中所含中子数为![]()
B.![]() 溶液中含有
溶液中含有![]() 数目小于
数目小于![]()
C.熔融状态下,![]() 中所含阳离子数目为2
中所含阳离子数目为2![]()
D.25°C时,![]() 的碳酸钠溶液中,由水电离出的
的碳酸钠溶液中,由水电离出的![]() 数目为
数目为![]()
科目:高中化学 来源: 题型:
【题目】电化学固氮可以在常温常压下实现氮气的还原合成氨,某课题组提出一种全新的电化学固氮机理——表面氢化机理示意图如下,则有关说法错误的是
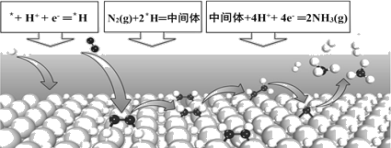
A.在表面氢化机理中,第一步是H+的还原反应
B.在表面*H原子与催化剂的协同作用下,N2与表面*H原子反应生成*N2H4中间体
C.电化学固氮法较传统工业合成氨法,具有能耗小、环境友好的优点
D.若竞争反应(析氢反应)的活化能显著低于固氮反应,则析氢反应的速率要远远高于固氮反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氮原子的最外层电子排布式是__;氮元素有多种化合价,列举一例含二种氮元素化合价的化合物__。
(2)肼(N2H4)分子可视为NH3分子的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。NH3分子的空间构型是__;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是__(化学式)。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)→3N2(g)+4H2O(g)+1038.7kJ,若该反应中有4molN-H键断裂,则形成的气体有__mol,其中转移电子数为__。
(4)肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__(填标号)
a.离子键 b.共价键 c.金属键 d.范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1 mol·L-1NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)=![]() ]如图所示:
]如图所示:
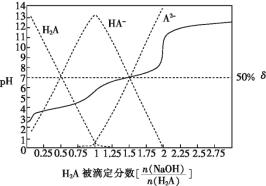
下列说法错误的是
A.用NaOH溶液滴定0.1 mol·L-1NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1Na2A溶液中:c(Na+)<c(HA-)+2c(A2-)
C.0.1 mol·L-1NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
D.H2A 的Ka2=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用酸性蚀刻废液(含Cu2+、H+、CuC![]() 、Cl-等)和碱性蚀刻废液[N
、Cl-等)和碱性蚀刻废液[N![]() 、Cu(NH3
、Cu(NH3![]() 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
、NH3·H2O等]制备CuI(白色固体)的实验流程如下:

(1)步骤Ⅰ中发生了多个反应,其中Cu(NH3![]() 与盐酸反应生成Cu(OH)Cl的离子方程式为______。
与盐酸反应生成Cu(OH)Cl的离子方程式为______。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是______。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、______、____。
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。

①装置a中盛装浓硫酸的仪器的名称是____,圆底烧瓶中发生反应的化学方程式为____。
②用装置d中的溶液洗涤制得的CuI的目的是____,然后再用无水乙醇洗涤的目的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列原子或原子团,请按要求选择两个,写出符合要求的有机物的结构简式:﹣CH3、﹣OH、﹣CHO、﹣COOH、﹣Br、﹣H、﹣CH2CH3、![]()
(l)分子结构为正四面体的是:___;
(2)能使FeCl3溶液显紫色的是:___;
(3)在NaOH乙醇溶液中能发生消去反应的是:____;
(4)1mol该有机物与足量的银氨溶液反应,有4molAg生成的是:___;
(5)相对分子质量是60,能和NaHCO3反应放出CO2的是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2+11O2=4B2O3 +2V2O5。下列说法不正确的是
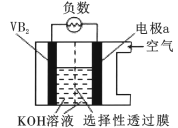
A. 电极a 为电池正极
B. 图中选择性透过膜为阴离子透过性膜
C. 电池工作过程中,电极a附近区域pH减小
D. VB2极发生的电极反应为:2VB2 +22OH--22e- = V2O5+2B2O3 + 11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰及其化合物在工农业生产和科技领域具有广泛的应用。
Ⅰ.溶液中的Mn2+可被酸性(NH4)2S2O8溶液氧化为MnO4-,同时(NH4)2S2O8被还原为SO42-,该方法可用于检验Mn2+。
(1)用酸性(NH4)2S2O8溶液检验Mn2+时的实验现象为____。
(2)该反应的离子方程式为____。
(3)已知H2S2O8中硫的化合价为+6,若硫酸的结构简式为![]() ,则H2S2O8的结构简式为____。
,则H2S2O8的结构简式为____。
Ⅱ.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn的工艺流程如图所示。
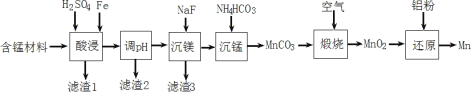
已知:①部分难溶物的溶度积常数如下表所示。
难溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
溶度积常数 | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
②当溶液中离子浓度≤1.0×10-5molL-1时,可认为该离子沉淀完全。
(1)“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为____;该过程中浸出时间和液固比对锰浸出率的影响分别如图所示。
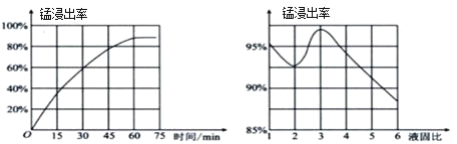
则适宜的浸出时间和液固比分别为____、____。
(2)若“酸浸”后所得滤液中c(Mn2+)=0.18molL-1,则应“调pH”的范围为____。
(3)“煅烧”反应中氧化剂与还原剂的物质的量之比为____。“还原”时发生的置换反应在化学上又叫作____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A、B、H都属于盐类,A和B的水溶液都能使酚酞变红,H是人们日常生活中最常用的食品添加剂之一,E是淡黄色固体
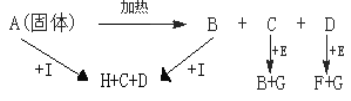
(1)写出下列物质的化学式E______________,I_______________
(2)写出下列反应的化学方程式
A→B+C+D__________________________________________
C+E→B+G__________________________________________
D+E→F+G__________________________________________
(3)写出下列反应的离子方程式
A+I→H+C+D________________________________________
B+I→H+C+D________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com