
【题目】实验室用酸性蚀刻废液(含Cu2+、H+、CuC![]() 、Cl-等)和碱性蚀刻废液[N
、Cl-等)和碱性蚀刻废液[N![]() 、Cu(NH3
、Cu(NH3![]() 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
、NH3·H2O等]制备CuI(白色固体)的实验流程如下:

(1)步骤Ⅰ中发生了多个反应,其中Cu(NH3![]() 与盐酸反应生成Cu(OH)Cl的离子方程式为______。
与盐酸反应生成Cu(OH)Cl的离子方程式为______。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是______。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、______、____。
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。

①装置a中盛装浓硫酸的仪器的名称是____,圆底烧瓶中发生反应的化学方程式为____。
②用装置d中的溶液洗涤制得的CuI的目的是____,然后再用无水乙醇洗涤的目的是____。
【答案】Cu(NH3![]() +3H++Cl-+H2O
+3H++Cl-+H2O![]() Cu(OH)Cl↓+4N
Cu(OH)Cl↓+4N![]() 热水浴 冷却结晶 过滤(洗涤) 分液漏斗 Cu+2H2SO4(浓)
热水浴 冷却结晶 过滤(洗涤) 分液漏斗 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 可防止CuI被空气中的O2氧化 使固体快速干燥并溶解表面可能混有的I2
CuSO4+SO2↑+2H2O 可防止CuI被空气中的O2氧化 使固体快速干燥并溶解表面可能混有的I2
【解析】
由流程图可知,酸性蚀刻废液和碱性蚀刻废液混合反应得到Cu(OH)Cl悬浊液,过滤,将Cu(OH)Cl加水、过浆后,与浓硫酸水浴加热反应生成硫酸铜,硫酸铜粗溶液经蒸发浓缩、冷却结晶、过滤、干燥、洗涤得到硫酸铜晶体,硫酸铜晶体与碘、二氧化硫和水反应生成碘化亚铜白色固体。
(1)步骤Ⅰ中Cu(NH3)42+与盐酸反应生成Cu(OH)Cl沉淀和氯化铵,反应的离子方程式Cu(NH3)42++3H++Cl-+H2O=Cu(OH)Cl↓+4NH4+,故答案为:Cu(NH3)42++3H++Cl-+H2O=Cu(OH)Cl↓+4NH4+;
(2)步骤Ⅳ为Cu(OH)Cl加水、过浆后,与浓硫酸在制pH为1~2,80 ℃下水浴加热反应反应生成硫酸铜,故答案为:热水浴;
(3)步骤Ⅴ为硫酸铜粗溶液经蒸发浓缩、冷却结晶、过滤、干燥、洗涤得到硫酸铜晶体,故答案为:冷却结晶;过滤(洗涤);
(4)①装置a中盛装浓硫酸的仪器为分液漏斗;圆底烧瓶中铜与浓硫酸共热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故答案为:分液漏斗;Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:分液漏斗;Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
②装置d中的溶液为二氧化硫的饱和水溶液,碘化亚铜具有还原性,易被空气中的氧气氧化,用二氧化硫水的饱和水溶液洗涤碘化亚铜,可以防止碘化亚铜被空气中的氧气氧化;再用无水乙醇洗涤可以溶解除去碘化亚铜表面可能混有的单质碘,并能使固体快速干燥,故答案为:可防止CuI被空气中的O2氧化;使固体快速干燥并溶解表面可能混有的I2。


科目:高中化学 来源: 题型:
【题目】由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。如图是氢氧燃料电池驱动LED发光的装置。
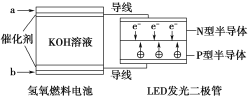
①a处通入的气体是氢气,b处通入的气体是氧气;
②该装置中只涉及两种形式的能量变化;
③电池正极的电极反应式为O2+2H2O+4e-=4OH-;
④P型半导体连接的是电池负极。上述说法中正确的是( )
A.①②B.①③C.③④D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示元素周期表中1~14周期的一部分,关于元素X、Y、Z、W的叙述错误的是( )
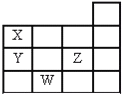
A.X、Y的最高价氧化物的水化物酸性为Y<X
B.Y、Z的气态氢化物的稳定性为Y<Z
C.Z有5种不同运动状态的电子
D.W的原子序数比Y大19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,常用作水果催熟剂,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示。

已知:醛可氧化生成羧酸。回答下列问题:
(1)写出下列物质的结构简式:A___;E___。
(2)写出下列反应的化学方程式,并注明反应类型:
①___、___;
②___、___;
④___、___;
(3)若想将B直接转化为D,可加入的物质为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铝条放入盛有过量稀硫酸的试管中,不能加快氢气产生速率的是( )
A.改铝条为镁条B.滴加少量![]() 溶液
溶液
C.不用稀硫酸改用98%的浓![]() D.升高溶液的温度
D.升高溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,![]() 中所含中子数为
中所含中子数为![]()
B.![]() 溶液中含有
溶液中含有![]() 数目小于
数目小于![]()
C.熔融状态下,![]() 中所含阳离子数目为2
中所含阳离子数目为2![]()
D.25°C时,![]() 的碳酸钠溶液中,由水电离出的
的碳酸钠溶液中,由水电离出的![]() 数目为
数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、妨织等工业。乙酸乙酯的实验室制法常采用如图装置:
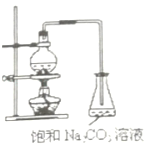
(1)烧瓶中除了乙酸和乙醇之外,还必须加的药品是___,其作用是___。
(2)能不能把饱和Na2CO3溶液换成饱和NaCl溶液?___,为什么?___。
(3)为了乙酸和乙醇回流,减少它们损失,该装置应该改进之处是:___。
(4)分离乙酸乙酯和饱和溶液,所需要的操作是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组利用以下装置制取并探究氨气的性质。在A装置中发生反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。

(1)B装置中的干燥剂是_____(填“碱石灰”或“浓硫酸”)。
(2)C、D装置中试纸颜色会发生变化的是_____(填”C”或“D”)。
(3)当实验进行段时间后,挤压E装置中的胶头滴管,滴入1--2滴浓盐酸,可观察到E装置中的现象是产生______(填”烟”或“白雾”)。
(4)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是_____(填“F”或“G”)。
(5)生石灰与水反应生成Ca(OH)2并放出热量。实验室利用此原理,向生石灰中滴加浓氨水,可以快速制取氨气。用此方法制取氨气应选用的气体发生装置是____(填“a”“b”或“c”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的废水中含有氰化物,可在碱性条件下对氰化物进行净化处理:2CN-+8OH- +5C12=2CO2+N2+10Cl-+4H2O。下列分析中错误的是( )
A.当反应消耗0.2 mol CN-时,反应中转移电子的物质的量是1 mol
B.还原性:CN->Cl-
C.CN-的电子式为![]()
D.该反应中氧化剂和还原剂的物质的量之比是2∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com