
【题目】酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、妨织等工业。乙酸乙酯的实验室制法常采用如图装置:
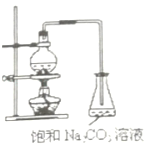
(1)烧瓶中除了乙酸和乙醇之外,还必须加的药品是___,其作用是___。
(2)能不能把饱和Na2CO3溶液换成饱和NaCl溶液?___,为什么?___。
(3)为了乙酸和乙醇回流,减少它们损失,该装置应该改进之处是:___。
(4)分离乙酸乙酯和饱和溶液,所需要的操作是___。
【答案】浓硫酸 催化剂和脱水剂 不能 NaCl溶液不能与乙酸反应除去乙酸 采用回流措施 分液
【解析】
⑴主要的药品有乙酸、乙醇、浓硫酸。
⑵饱和碳酸钠溶液与乙酸反应除去乙酸、溶解乙醇,同时降低乙酸乙酯的溶解度,便于分层,而NaCl溶液不能与乙酸反应除去乙酸。
⑶为了乙酸和乙醇回流,减少它们损失,采用回流措施。
⑷用分液分离出乙酸乙酯。
⑴烧瓶中除了乙酸和乙醇之外,还必须加的药品是浓硫酸;浓硫酸作催化剂和脱水剂;故答案为:浓硫酸;催化剂和脱水剂。
⑵饱和碳酸钠溶液与乙酸反应除去乙酸、溶解乙醇,同时降低乙酸乙酯的溶解度,便于分层,而NaCl溶液不能与乙酸反应除去乙酸;故答案为:不能;NaCl溶液不能与乙酸反应除去乙酸。
⑶为了乙酸和乙醇回流,减少它们损失,该装置应该改进之处是:采用回流措施;故答案为:采用回流措施。
⑷乙酸乙酯和碳酸钠饱和溶液是不溶的,采用分液的方法分离,故答案为:分液。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+= -lgc(Ag+),其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )

A.Ksp(Ag2CrO4)约为1 ×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Cl-、CrO42-均为0.1 mol/ L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
D.向Ag2CrO4、AgCl混合固体和水的溶解平衡体系中加入少量水, 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学的核心是发生化学反应,利用化学反应合成物质,同时也伴随有能量的变化,下列有关说法中不正确的是( )
A.只要发生化学反应就一定有能量变化
B.Zn+2HCl=ZnCl2+H2↑这是一个放热反应,结论:1molZn和2molHCl的能量之和高于1molZnCl2和1molH2的能量之和
C.反应A+B=C+D的能量变化如图所示,反应物A和B断裂化学键吸收总能量低于形成生成物C和D释放的总能量

D.发生化学反应实现了化学能和其他形式能量之间的相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用酸性蚀刻废液(含Cu2+、H+、CuC![]() 、Cl-等)和碱性蚀刻废液[N
、Cl-等)和碱性蚀刻废液[N![]() 、Cu(NH3
、Cu(NH3![]() 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
、NH3·H2O等]制备CuI(白色固体)的实验流程如下:

(1)步骤Ⅰ中发生了多个反应,其中Cu(NH3![]() 与盐酸反应生成Cu(OH)Cl的离子方程式为______。
与盐酸反应生成Cu(OH)Cl的离子方程式为______。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是______。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、______、____。
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。

①装置a中盛装浓硫酸的仪器的名称是____,圆底烧瓶中发生反应的化学方程式为____。
②用装置d中的溶液洗涤制得的CuI的目的是____,然后再用无水乙醇洗涤的目的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能得出相应结论的是( )
实验 | 现象 | 结论 | |
A | 向浓度均为 |
| 非金属性: |
B. | 向含有酚酞的 | 观察到红色变浅 | 证明 |
C | 室温下,用pH试纸测 |
|
|
D. | 向盛有10滴 | 有黄色沉淀生成 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2+11O2=4B2O3 +2V2O5。下列说法不正确的是
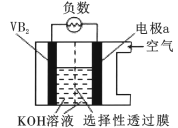
A. 电极a 为电池正极
B. 图中选择性透过膜为阴离子透过性膜
C. 电池工作过程中,电极a附近区域pH减小
D. VB2极发生的电极反应为:2VB2 +22OH--22e- = V2O5+2B2O3 + 11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究水体中碘的存在形态及其转化是近年的科研热点。I-与I2在水体和大气中的部分转化如下图所示。
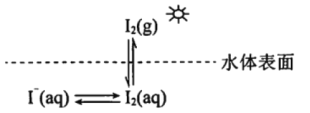
(1) I2的电子式为______________。
(2)水体中的I-在非酸性条件下难于被空气中的![]() 氧化。原因是
氧化。原因是![]() 的反应速率慢,反应程度小。
的反应速率慢,反应程度小。
①I-在酸性条件下与![]() 反应的离子方程式是_____________________________________。
反应的离子方程式是_____________________________________。
②在酸性条件下I-易被![]() 氧化的可能的原因是______________________________________。
氧化的可能的原因是______________________________________。
(3)有资料显示:水体中若含有![]() ,会对
,会对![]() 氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的
氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的![]() 通入到
通入到![]() 下列试剂中,一段时间后,记录实验现象与结果。己知:每
下列试剂中,一段时间后,记录实验现象与结果。己知:每![]() 参与反应,生成
参与反应,生成![]() 。
。
序号 | 试剂组成 | 反应前溶液的 | 反应后溶液的 |
|
|
甲 |
| 5.3 | 11.0 | 约10% | |
乙 |
| 5.1 | 4.1 | 约100% | 大量 |
丙 |
| 5.2 | 3.5 | —— | 少量 |
①![]() _______________________。
_______________________。
②甲中反应为可逆反应,其离子方程式是________________________。
③比较甲、乙、丙实验,说明![]() 在实验乙中的作用并解释_______________________。
在实验乙中的作用并解释_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物对化工生产有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g);△H=+180kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-908kJ·mol-1
请写出氨气被一氧化氮氧化生成无毒气体的热化学方程式:____。
(2)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1。如图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为k)对该平衡的影响。
2NH3(g) ΔH=-92.4kJ·mol-1。如图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为k)对该平衡的影响。

①已知图甲中0~t1min内,v(H2)=0.03mol·L-1·min-1,则t1=____min;若从t2min起仅改变一个反应条件,则所改变的条件可能是____(填一种即可)。
②图乙中,b点时k=____。
③已知某温度下该反应的平衡常数K=10,在该温度下向容器中同时加入下列浓度的混合气体:c(H2)=0.1mol/L,c(N2)=0.5mol/L,c(NH3)=0.1mol/L,则在平衡建立过程中NH3的浓度变化趋势是____(填“逐渐增大”“逐渐减小”或“恒定不变”)。
(3)联氨(又称肼,N2H4,无色液体)为二元弱碱,在水中的电离方式与氨相似,是一种应用广泛的化工原料,可用作火箭燃料。(已知:N2H4+H+![]() N2H5+)
N2H5+)
①N2H5+的电子式为____。联氨与硫酸形成的酸式盐的化学式为____。
②联氨是一种常用的还原剂。写出向装有少量AgCl的试管中加入联氨溶液的化学方程式____。
(4)尿素(CO(NH2)2)是目前使用量较大的一种化学氮肥,工业上利用如图所示装置(阴、阳极均为惰性电极)电解尿素的碱性溶液制取氢气。
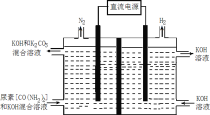
①该装置中阳极的总电极反应式为____。
②若两极共收集到气体22.4L(标准状况),则消耗的尿素为____g(忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr![]() C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________。
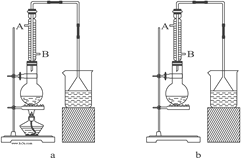
(2)反应装置中的烧瓶应选择下列哪种规格最合适(_____)
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是(_____)
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)可能发生的副反应为:_____________、__________、______________(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com