
����Ŀ���о������仯����Ի�����������Ҫ���塣
��1����֪��N2(g)+O2(g)=2NO(g)����H=+180kJ��mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)����H=-908kJ��mol-1
��д��������һ����������������������Ȼ�ѧ����ʽ��____��
��2����ҵ�ϳɰ���ԭ��Ϊ��N2(g)+3H2(g)![]() 2NH3(g) ��H=-92.4kJ��mol-1����ͼ�ױ�ʾ��һ��������ܱ������з�ӦʱN2�����ʵ���Ũ����ʱ��ı仯��ͼ�ұ�ʾ�������������������£��ı���ʼͶ����H2��N2�����ʵ���֮�ȣ���Ϊk���Ը�ƽ���Ӱ�졣
2NH3(g) ��H=-92.4kJ��mol-1����ͼ�ױ�ʾ��һ��������ܱ������з�ӦʱN2�����ʵ���Ũ����ʱ��ı仯��ͼ�ұ�ʾ�������������������£��ı���ʼͶ����H2��N2�����ʵ���֮�ȣ���Ϊk���Ը�ƽ���Ӱ�졣

����֪ͼ����0��t1min�ڣ�v(H2)=0.03mol��L-1��min-1����t1=____min������t2min����ı�һ����Ӧ�����������ı������������____����һ�ּ��ɣ���
��ͼ���У�b��ʱk=____��
����֪ij�¶��¸÷�Ӧ��ƽ�ⳣ��K=10���ڸ��¶�����������ͬʱ��������Ũ�ȵĻ�����壺c(H2)=0.1mol/L��c(N2)=0.5mol/L��c(NH3)=0.1mol/L������ƽ�⽨��������NH3��Ũ�ȱ仯������____������������������С�������㶨����������
��3���������ֳ��£�N2H4����ɫҺ�壩Ϊ��Ԫ�����ˮ�еĵ��뷽ʽ�백���ƣ���һ��Ӧ�ù㷺�Ļ���ԭ�ϣ����������ȼ�ϡ�����֪��N2H4+H+![]() N2H5+��
N2H5+��
��N2H5+�ĵ���ʽΪ____�������������γɵ���ʽ�εĻ�ѧʽΪ____��
��������һ�ֳ��õĻ�ԭ����д����װ������AgCl���Թ��м���������Һ�Ļ�ѧ����ʽ____��
��4������(CO(NH2)2)��Ŀǰʹ�����ϴ��һ�ֻ�ѧ���ʣ���ҵ��������ͼ��ʾװ��(����������Ϊ���Ե缫)������صļ�����Һ��ȡ������
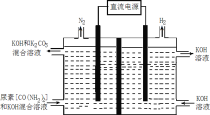
�ٸ�װ�����������ܵ缫��ӦʽΪ____��
�����������ռ�������22.4L(��״��)�������ĵ�����Ϊ____g(����������ܽ�)��
���𰸡�4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ��H=-1808kJ��mol-1 30 �����¶ȣ�������H2Ũ�ȡ���СNH3Ũ�ȣ� 3��1 ��С 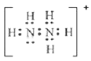 N2H6(HSO4)2 N2H4+4AgCl=N2��+4Ag+4HCl����3N2H4+4AgCl=N2��+4Ag+2N2H6Cl2�� CO(NH2)2+8OH--6e-=N2��+CO32-+6H2O 15
N2H6(HSO4)2 N2H4+4AgCl=N2��+4Ag+4HCl����3N2H4+4AgCl=N2��+4Ag+2N2H6Cl2�� CO(NH2)2+8OH--6e-=N2��+CO32-+6H2O 15
��������
�Ÿ��ݸ�˹���ɣ��ڶ�������ʽ��ȥ��һ������ʽ��5�����õ�������һ����������������������Ȼ�ѧ����ʽ��
�Ƣ�����֮�ȵ��ڻ�ѧ������֮�ȣ�Ȼ��������ʵļ��㹫ʽ���ʱ�䣻N2�����ʵ���Ũ����ʱ��ı仯ͻȻ��С�����Ӱ�컯ѧƽ�����������𣻢ڵ�N2��H2����ʼ����ȷ��Ϸ���ʽ�л�ѧ������֮��ʱ���ﵽƽ��ʱ�������������ۼ���Ũ���̺ͻ�ѧƽ�ⳣ���Ƚϣ��жϻ�ѧƽ���ƶ��������ж�ƽ�⽨��������NH3��Ũ�ȱ仯���ơ�
�Ǣٸ���N2H4����ʽ������N2H5+�ĵ���ʽ�����к���һ�Թ¶Ե��ӿ��Ժ��������γ���λ��������Ϊ��Ԫ����γ�+2�������ӣ����������������������ɵ����������ӱ���ԭ���ɵ�������
�ȵ�һ�������ǵ缫��Ӧʽ����д�����ȴӼ�̬�仯�ϣ��ж������ϲ���������Ȼ����ݻ��ϼ۵ı仯�͵��ӵ�ʧ�غ㣬����غ㣬��д��ϵʽ�����ݵ����غ���������������ʵ�����������
�Ÿ��ݸ�˹���ɽ��ڶ�������ʽ��ȥ��һ������ʽ��5�����õ�������һ����������������������Ȼ�ѧ����ʽ��4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ��H=908 kJ��mol1 5��(+180 kJ��mol1) = 1808 kJ��mol1���ʴ�Ϊ��4NH3(g)+6NO(g) =5N2(g)+6H2O(g) ��H=1808 kJ��mol1��
�Ƣ���֪ͼ����0��t1min�ڣ���(H2) = 0.03mol��L1��min1����(N2) = ![]() ��(H2) =
��(H2) = ![]() ��0.03mol��L1��min1 = 0.01 mol��L1��min1=
��0.03mol��L1��min1 = 0.01 mol��L1��min1= ![]() ����t1=30 min������t2min����ı�һ����Ӧ����������Ũ�Ƚ��ͣ��ı�����������ǽ����¶�(������H2Ũ�ȡ���СNH3Ũ��)���ʴ�Ϊ��30�������¶�(������H2Ũ�ȡ���СNH3Ũ��)��
����t1=30 min������t2min����ı�һ����Ӧ����������Ũ�Ƚ��ͣ��ı�����������ǽ����¶�(������H2Ũ�ȡ���СNH3Ũ��)���ʴ�Ϊ��30�������¶�(������H2Ũ�ȡ���СNH3Ũ��)��
�ڵ�N2��H2����ʼ����ȷ��Ϸ���ʽ�л�ѧ������֮��ʱ���ﵽƽ��ʱ��������������ͼ���У�b��ʱk=3��1���ʴ�Ϊ��3��1��
����֪ij�¶��¸÷�Ӧ��ƽ�ⳣ��K=10���ڸ��¶�����������ͬʱ��������Ũ�ȵĻ�����壺c(H2)=0.1mol/L��c(N2)=0.5mol/L��c(NH3)=0.1mol/L������![]() ��ƽ�������ƶ��������ƽ�⽨��������NH3��Ũ�ȱ仯��������С���ʴ�Ϊ����С��
��ƽ�������ƶ��������ƽ�⽨��������NH3��Ũ�ȱ仯��������С���ʴ�Ϊ����С��
�Ǣ�N2H4�е���֮�乲��һ�Ե��ӣ��������һ�Ե��ӣ�N2H5+��N2H4��H+�γ���λ���������ʽΪ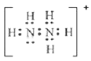 �������������γɵ���ʽ�Σ���ʽ����HSO4��������(�ֳ��£�N2H4����ɫҺ��)Ϊ��Ԫ����γɵ�������ΪN2H62+������γɵ���ʽ�εĻ�ѧʽΪN2H6(HSO4)2���ʴ�Ϊ��
�������������γɵ���ʽ�Σ���ʽ����HSO4��������(�ֳ��£�N2H4����ɫҺ��)Ϊ��Ԫ����γɵ�������ΪN2H62+������γɵ���ʽ�εĻ�ѧʽΪN2H6(HSO4)2���ʴ�Ϊ��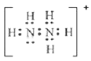 ��N2H6(HSO4)2��
��N2H6(HSO4)2��
��������һ�ֳ��õĻ�ԭ��������AgCl���Թ��м���������Һ��Ӧ���ɵ���������HCl���仯ѧ����ʽN2H4+4AgCl=N2��+4Ag+4HCl(��3N2H4+4AgCl=N2��+4Ag+2N2H6Cl2)���ʴ�Ϊ��N2H4+4AgCl=N2��+4Ag+4HCl(��3N2H4+4AgCl=N2��+4Ag+2N2H6Cl2)��
�Ȣٵ����������е����ϼ�����ʧȥ���ӷ���������Ӧ���ڵ����������Ӧ�����������ܵ缫��ӦʽΪCO(NH
�ڸ���6e����N2��3H2��CO(NH2)2��ת��6mol�����ռ���4mol���壬����1mol���أ����������ռ�������22.4L(��״��)��1mol���壬���ĵ��������ʵ���![]() ������Ϊ0.25mol��60 gmol 1 =15g���ʴ�Ϊ��15��
������Ϊ0.25mol��60 gmol 1 =15g���ʴ�Ϊ��15��


 ����ѧ���ʱѧ����ϵ�д�
����ѧ���ʱѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾԪ�����ڱ���1~14���ڵ�һ���֣�����Ԫ��X��Y��Z��W������������ǣ� ��
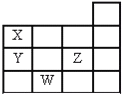
A.X��Y������������ˮ��������ΪY��X
B.Y��Z����̬�⻯����ȶ���ΪY��Z
C.Z��5�ֲ�ͬ�˶�״̬�ĵ���
D.W��ԭ��������Y��19
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ���л��ϳ��м��壬�㷺Ӧ�����ܼ������ܼ������ϡ���֯�ȹ�ҵ������������ʵ�����Ʒ���������ͼװ�ã�
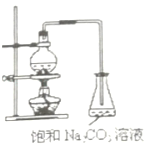
��1����ƿ�г���������Ҵ�֮�⣬������ӵ�ҩƷ��___����������___��
��2���ܲ��ܰѱ���Na2CO3��Һ���ɱ���NaCl��Һ��___��Ϊʲô��___��
��3��Ϊ��������Ҵ�����������������ʧ����װ��Ӧ�øĽ�֮���ǣ�___��
��4���������������ͱ�����Һ������Ҫ�IJ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о���ѧϰС����������װ����ȡ��̽�����������ʡ���Aװ���з�����Ӧ�Ļ�ѧ����ʽΪ2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��

��1��Bװ���еĸ������_____(������ʯ��������Ũ������)��
��2��C��Dװ������ֽ��ɫ�ᷢ���仯����_____(����C������D��)��
��3����ʵ����ж�ʱ���ѹEװ���еĽ�ͷ�ιܣ�����1--2��Ũ���ᣬ�ɹ۲쵽Eװ���е������Dz���______(������������������)��
��4��Ϊ��ֹ����������ɿ�����Ⱦ����Ҫ������װ�õ�ĩ������һ��β������װ�ã����ʵ�װ����_____(����F������G��)��
��5����ʯ����ˮ��Ӧ����Ca(OH)2���ų�������ʵ�������ô�ԭ��������ʯ���еμ�Ũ��ˮ�����Կ�����ȡ�������ô˷�����ȡ����Ӧѡ�õ����巢��װ����____(����a����b������c��)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Y�Ǻϳ����ϡ�ҽҩ��ũҩ��Ⱦ�ϵ���Ҫ�м��壬����X��һ�������ºϳɣ�

����˵������ȷ����
A. Y�ķ���ʽΪC10H8O3
B. ��X��ȡY�Ĺ����пɵõ��Ҵ�
C. һ�������£�Y�ܷ����Ӿ۷�Ӧ�����۷�Ӧ
D. �����ʵ�����X��Y�ֱ���NaOH��Һ��Ӧ���������NaOH�����ʵ���֮��Ϊ3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֲ�ͬ�ѻ���ʽ�Ľ�������ľ�����ͼ��ʾ���й�˵����ȷ����(���������Ħ������ΪMg��mol-1����ԭ�Ӱ뾶Ϊr cm����NA��ʾ�����ӵ�������ֵ)

A.����Zn���âڶѻ���ʽ
B.�ٺ͢���ԭ�ӵ���λ���ֱ�Ϊ��6��8
C.���ڲ��âڶѻ���ʽ�Ľ����ľ�������Ϊ![]()
D.������ѹʱ�����ƻ��ܶѻ������з�ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ᣨH3BO3����һ��Ƭ��״�ṹ��ɫ���壬����ʯī���ƵIJ�״�ṹ�������ֽ⣬���ڵ�H3BO3����ͨ�������������ͼ��ʾ�����������й�˵���в���ȷ����

A. �����ᾧ�����ڷ��Ӿ���
B. ��������ӵ��ȶ����������
C. 1molH3BO3�������3mol���
D. Bԭ���ӻ����������sp2������H3BO3����ͨ�����ۼ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ŷŵķ�ˮ�к����軯����ڼ��������¶��軯����о���������2CN-+8OH- +5C12=2CO2+N2+10Cl-+4H2O�����з����д�����ǣ� ��
A.����Ӧ����0.2 mol CN-ʱ����Ӧ��ת�Ƶ��ӵ����ʵ�����1 mol
B.��ԭ��:CN->Cl-
C.CN-�ĵ���ʽΪ![]()
D.�÷�Ӧ���������ͻ�ԭ�������ʵ���֮����2��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��5������������������Ҫ���л��ϳ��м��壬��������Ȼ���ʰ������صĺϳɣ�һ���Լ䱽����Ϊԭ�ϵĺϳɷ�Ӧ���£�

�״������Ѻ�3��5�������������ӵIJ����������ʼ��±���

��1����Ӧ�������ȷ�����״����ټ������ѽ�����ȡ���ٷ�����״��IJ����ǵ�______������ȡ�õ��ķ�Һ©��ʹ��ǰ��__________________��ϴ������Һʱ�л����ڷ�Һ©����________����ϡ����¡����㣻
��2������õ����л��������ñ���NaHCO3��Һ������ʳ��ˮ����������ˮ����ϴ�ӣ��ñ���NaHCO3��Һϴ�ӵ�Ŀ����__���ñ���ʳ��ˮϴ�ӵ�Ŀ����______��
��3��ϴ����ɺ�ͨ�����²������롢�ᴿ�����ȷ�IJ���˳����__������ĸ����
a�������ȥ���� b���ؽᾧ c�����˳�ȥ����� d��������ˮCaCl2����
��4����Һ���볣���ü�ѹ���ˣ�Ϊ�˷�ֹ��������ѹ������ɺ�Ӧ��________________����______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com