
【题目】研究水体中碘的存在形态及其转化是近年的科研热点。I-与I2在水体和大气中的部分转化如下图所示。
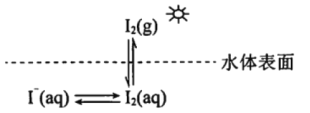
(1) I2的电子式为______________。
(2)水体中的I-在非酸性条件下难于被空气中的![]() 氧化。原因是
氧化。原因是![]() 的反应速率慢,反应程度小。
的反应速率慢,反应程度小。
①I-在酸性条件下与![]() 反应的离子方程式是_____________________________________。
反应的离子方程式是_____________________________________。
②在酸性条件下I-易被![]() 氧化的可能的原因是______________________________________。
氧化的可能的原因是______________________________________。
(3)有资料显示:水体中若含有![]() ,会对
,会对![]() 氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的
氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的![]() 通入到
通入到![]() 下列试剂中,一段时间后,记录实验现象与结果。己知:每
下列试剂中,一段时间后,记录实验现象与结果。己知:每![]() 参与反应,生成
参与反应,生成![]() 。
。
序号 | 试剂组成 | 反应前溶液的 | 反应后溶液的 |
|
|
甲 |
| 5.3 | 11.0 | 约10% | |
乙 |
| 5.1 | 4.1 | 约100% | 大量 |
丙 |
| 5.2 | 3.5 | —— | 少量 |
①![]() _______________________。
_______________________。
②甲中反应为可逆反应,其离子方程式是________________________。
③比较甲、乙、丙实验,说明![]() 在实验乙中的作用并解释_______________________。
在实验乙中的作用并解释_______________________。
【答案】![]()
![]()
![]() 增大,
增大,![]() 减小,使平衡
减小,使平衡![]() 正向移动,反应易于进行等其他合理答案
正向移动,反应易于进行等其他合理答案 ![]()
![]()
![]() 或
或![]() 的氧化产物
的氧化产物![]() 与
与![]() 和
和![]() 反应产生的
反应产生的![]() 结合,促使该平衡正向移动,提高了
结合,促使该平衡正向移动,提高了![]() 的转化率等其他合理答案
的转化率等其他合理答案
【解析】
(1)根据成键方式书写电子式;(2)根据氧化还原反应原理书写反应方程式,并根据平衡移动原理分析解答;(3)根据实验数据及平衡移动原理分析解答。
(1) I2属于共价分子,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)①根据题干信息分析,I-在酸性条件下被![]() 氧化生成I2,反应的离子方程式是
氧化生成I2,反应的离子方程式是![]() ;
;
②根据提给信息中I-在非酸性条件下被氧化的反应方程式分析知,在酸性条件下I-易被![]() 氧化的可能的原因是
氧化的可能的原因是![]() 增大,
增大,![]() 减小,使平衡
减小,使平衡![]() 正向移动,反应易于进行,故答案为:
正向移动,反应易于进行,故答案为:![]() ;
;![]() 增大,
增大,![]() 减小,使平衡
减小,使平衡![]() 正向移动,反应易于进行等;
正向移动,反应易于进行等;
(3)①验证Fe2+对O3氧化I-产生的影响时,必须排除其它干扰因素,所以A、B组对照实验中c(Cl-)要相同,即c(NaCl)=2c(FeCl2)=2×1.5×10-2mol/L=3×10-2mol/L,故答案为:3×10-2;
②O3氧化I-时溶液显碱性,说明生成了碱性物质或离子,离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
③Fe2+具有强还原性,易被O3氧化生成Fe3+,Fe2+或Fe3+结合OH-生成弱碱,促使反应![]() 正向进行,提高I-转化率,故答案为:
正向进行,提高I-转化率,故答案为: ![]() 或
或![]() 的氧化产物
的氧化产物![]() 与
与![]() 和
和![]() 反应产生的
反应产生的![]() 结合,促使该平衡正向移动,提高了
结合,促使该平衡正向移动,提高了![]() 的转化率。
的转化率。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】水合草酸亚铁(FeC2O4·xH2O)在制药工业上有广泛应用。以莫尔盐[(NH4)2SO4·FeSO4·6H2O]为原料制备FeC2O4·xH2O,并探究其性质。回答下列问题:
已知:草酸亚铁晶体为淡黄色粉末,难溶于水,溶于稀酸;pH>4时,Fe2+容易被氧化。
I.制备FeC2O4·xH2O(如图)
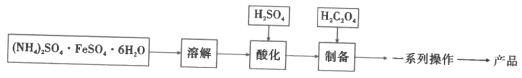
(1)加入H2SO4的目的是__。
(2)制备步骤的离子方程式是__。
(3)一系列操作是__。
II.探究FeC2O4·xH2O的分解产物:CO2、CO(如图)
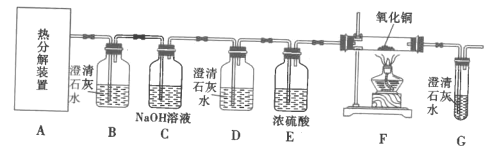
(4)装置D的作用是__,证明分解产物中存在CO的现象是__。
(5)从绿色化学角度考虑,实验存在不足之处,指出并提出解决方案:__。
III.定量测定FeC2O4·xH2O的化学式[M(FeC2O4)=144]
操作步骤:准确称取mg草酸亚铁晶体,溶于V1mL、c1mol·L-1的H2SO4溶液中,加热,用KMnO4标准溶液滴定至终点,加入锌粉将Fe3+恰好全部还原为Fe2+,然后用c2mol·L-1KMnO4标准溶液滴定至终点,记录消耗KMnO4标准溶液的体积为V2mL。
(6)第二次使用KMnO4标准溶液滴定的离子方程式为__。
(7)x=_(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铝条放入盛有过量稀硫酸的试管中,不能加快氢气产生速率的是( )
A.改铝条为镁条B.滴加少量![]() 溶液
溶液
C.不用稀硫酸改用98%的浓![]() D.升高溶液的温度
D.升高溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、妨织等工业。乙酸乙酯的实验室制法常采用如图装置:
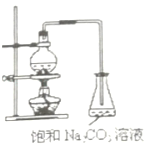
(1)烧瓶中除了乙酸和乙醇之外,还必须加的药品是___,其作用是___。
(2)能不能把饱和Na2CO3溶液换成饱和NaCl溶液?___,为什么?___。
(3)为了乙酸和乙醇回流,减少它们损失,该装置应该改进之处是:___。
(4)分离乙酸乙酯和饱和溶液,所需要的操作是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质。下表所列各组物质之间通过一步反应不能实现如图所示转化的是( )
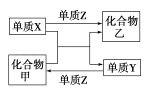
选项 | X | Y | Z | 甲 | 乙 |
A | C | H2 | O2 | H2O | CO |
B | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
C | Mg | C | O2 | CO2 | MgO |
D | H2 | Si | Cl2 | SiCl4 | HCl |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组利用以下装置制取并探究氨气的性质。在A装置中发生反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。

(1)B装置中的干燥剂是_____(填“碱石灰”或“浓硫酸”)。
(2)C、D装置中试纸颜色会发生变化的是_____(填”C”或“D”)。
(3)当实验进行段时间后,挤压E装置中的胶头滴管,滴入1--2滴浓盐酸,可观察到E装置中的现象是产生______(填”烟”或“白雾”)。
(4)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是_____(填“F”或“G”)。
(5)生石灰与水反应生成Ca(OH)2并放出热量。实验室利用此原理,向生石灰中滴加浓氨水,可以快速制取氨气。用此方法制取氨气应选用的气体发生装置是____(填“a”“b”或“c”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是
A. Y的分子式为C10H8O3
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能发生加聚反应和缩聚反应
D. 等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法中不正确的是

A. 正硼酸晶体属于分子晶体
B. 正硼酸分子的稳定性与氢键无关
C. 1molH3BO3晶体中含有3mol氢键
D. B原子杂化轨道的类型sp2,层间的H3BO3分子通过共价键相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)氟化钙为无色结晶体或白色粉末,难溶于水,主要用于冶金、化工、建材三大行业,目前我国利用氟硅酸(H2SiF6)生产氟化钙有多种方案,氨法碳酸钙法是制备氟化钙的常见方案,其工艺流程如图所示。请回答下列问题:
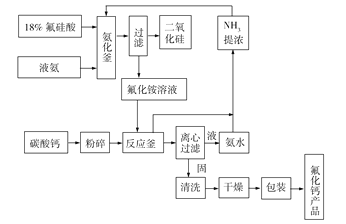
(1)萤石含有较多的氟化钙,在炼钢过程中,要加入少量的萤石,推测萤石的主要作用是________(填字母)。
A.还原剂 B.助熔剂 C.升温剂 D.增碳剂
(2)请写出氨化釜中反应的化学方程式:_______________________________。
(3)反应釜中产生两种气体,溶于水后一种显酸性,一种显碱性,请写出反应釜中反应的离子方程式:__________________________________。
(4)从经济效益和环境效益上分析,本工艺为了节约资源,经过必要的处理可循环利用的物质是________。
(5)本工艺用CaCO3作原料的优点为___________________________________(任写两条);查文献可知3Ca(OH)2+H2SiF6![]() 3CaF2+SiO2+4H2O,请叙述此方法制备CaF2的最大难点是______________。
3CaF2+SiO2+4H2O,请叙述此方法制备CaF2的最大难点是______________。
(6)以1 t 18%氟硅酸为原料,利用上述氨法碳酸钙法制备CaF2,最后洗涤、干燥、称量得到0.25 t 纯净的CaF2,请计算CaF2的产率为__________%(保留整数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com