
【题目】水合草酸亚铁(FeC2O4·xH2O)在制药工业上有广泛应用。以莫尔盐[(NH4)2SO4·FeSO4·6H2O]为原料制备FeC2O4·xH2O,并探究其性质。回答下列问题:
已知:草酸亚铁晶体为淡黄色粉末,难溶于水,溶于稀酸;pH>4时,Fe2+容易被氧化。
I.制备FeC2O4·xH2O(如图)
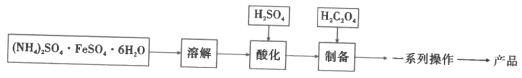
(1)加入H2SO4的目的是__。
(2)制备步骤的离子方程式是__。
(3)一系列操作是__。
II.探究FeC2O4·xH2O的分解产物:CO2、CO(如图)
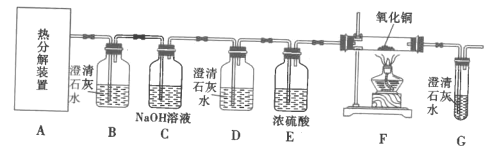
(4)装置D的作用是__,证明分解产物中存在CO的现象是__。
(5)从绿色化学角度考虑,实验存在不足之处,指出并提出解决方案:__。
III.定量测定FeC2O4·xH2O的化学式[M(FeC2O4)=144]
操作步骤:准确称取mg草酸亚铁晶体,溶于V1mL、c1mol·L-1的H2SO4溶液中,加热,用KMnO4标准溶液滴定至终点,加入锌粉将Fe3+恰好全部还原为Fe2+,然后用c2mol·L-1KMnO4标准溶液滴定至终点,记录消耗KMnO4标准溶液的体积为V2mL。
(6)第二次使用KMnO4标准溶液滴定的离子方程式为__。
(7)x=_(用字母表示)。
【答案】降低pH,防止Fe2+被氧化和水解 Fe2++H2C2O4+xH2O=FeC2O4·xH2O+2H+ 过滤,洗涤,干燥 检验CO2是否已除尽 F中生成红色固体,G中澄清石灰水变浑浊 有毒的CO尾气未处理,G后接酒精灯点燃或吸收CO的尾气处理装置 5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O ![]()
【解析】
Ⅰ.莫尔盐[(NH4)2SO4·FeSO4·6H2O]溶于水后溶液中存在NH4+、Fe2+、SO42-离子,Fe2+离子易水解且易被氧化,加入H2SO4酸化可以防止Fe2+离子被氧化和水解,与H2C2O4反应制得FeC2O4·xH2O;
Ⅱ.检验CO2、CO的混合物,需要先用B装置检验CO2的存在,用C装置中的NaOH溶液除去混合气体中的CO2,用D装置检验CO2是否除尽,防止对后续实验造成干扰,E装置干燥气体,通过F和G装置的实验现象检验CO的存在;
Ⅲ.第一次加入高锰酸钾后,将Fe2+和C2O42-氧化成Fe3+和CO2,加入锌粉还原Fe3+后,第二次加入高锰酸钾仅氧化Fe2+。
Ⅰ.莫尔盐[(NH4)2SO4·FeSO4·6H2O]溶于水后溶液中存在NH4+、Fe2+、SO42-离子,Fe2+离子易水解且易被氧化,加入H2SO4酸化可以防止Fe2+离子被氧化和水解,与H2C2O4反应制得FeC2O4·xH2O;
(1)根据题目信息可得,加入H2SO4的目的是降低pH,防止Fe2+被氧化和水解;
(2)制备步骤的离子方程式是Fe2++H2C2O4+xH2O=FeC2O4·xH2O+2H+;
(3)一系列的操作是将FeC2O4·xH2O分离提纯的过程,由于难溶于水,则需要过滤,洗涤,干燥得到产品;
Ⅱ.检验CO2、CO的混合物,需要先用B装置检验CO2的存在,用C装置中的NaOH溶液除去混合气体中的CO2,用D装置检验CO2是否除尽,防止对后续实验造成干扰,E装置干燥气体,通过F和G装置的实验现象检验CO的存在;
(4)装置D的作用是检验CO2是否已除尽,若存在CO,CO与F中氧化铜反应生成单质铜和CO2,G中澄清石灰水变浑浊;
(5)CO有毒,该实验没有尾气处理装置,应该在G后用酒精灯点燃或接吸收CO的尾气处理装置;
Ⅲ.第一次加入高锰酸钾后,将Fe2+和C2O42-氧化成Fe3+和CO2,加入锌粉还原Fe3+后,第二次加入高锰酸钾仅氧化Fe2+;
(6)第二次使用KMnO4标准溶液滴定的离子方程式为5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O;
(7)由化学方程式中各物质的物质的量关系可得:

![]() =
=![]()
解得x=![]() 。
。


科目:高中化学 来源: 题型:
【题目】铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于_________区。
(2)Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ ,请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别:_________。Mn2+的半径_________ Fe3+的半径(填“>”、“<”或“=”)。
(3)金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为_________(用含π的式子表示)。
(4)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。N、H、O三种元素的电负性由大到小的顺序为_________;[Fe(SCN)(H2O)5]2+中Fe3+的配位数为_________,H2O中氧原子的杂化方式为_________。
(5)二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2,可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H![]() )配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π
)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H![]() 的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
A 离子键 B 配位键 C σ 键 D 范德华力
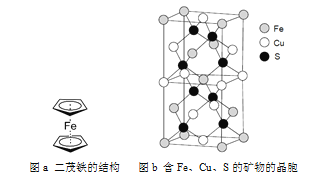
(6)一种含有Fe、Cu、S三种元素的矿物的晶胞(如上图b所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为A pm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________ g/cm3(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+= -lgc(Ag+),其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )

A.Ksp(Ag2CrO4)约为1 ×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Cl-、CrO42-均为0.1 mol/ L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
D.向Ag2CrO4、AgCl混合固体和水的溶解平衡体系中加入少量水, 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要含Al2O3、SiO2,还有少量的Fe2O3)为原料制取Al2O3的流程如下:
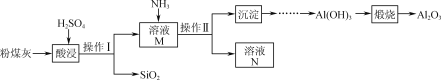
(1)操作Ⅰ的名称是________;溶液N中的溶质主要是____________(填化学式)。
(2)用H2SO4“酸浸”时的离子方程式为__________________________________(任写一个)。
(3)“煅烧”时的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向1L0.1mol·L-1MgCl2和MnCl2溶液中加入Na2CO3,固体(忽略体积变化),如图为加入Na2CO3的物质的量与-1gc(Mg2+)或-lgc(Mn2+)之间的关系,已知常温下Ksp(MgCO3)>Ksp(MnCO3),下列说法正确的是( )
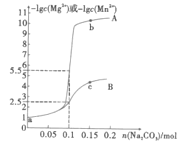
A.曲线A是n(Na2CO3)与-lgc(Mg2+)的关系曲线
B.Ksp(MnCO3)和Ksp(MgCO3)相差3个数量级
C.若将b点和c点溶液混合,存在![]() =1×106
=1×106
D.a点(MgCl2溶液)中存在:c(Mg2+)+c(H+)=c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体(MgSO4·7H2O)的流程如图:
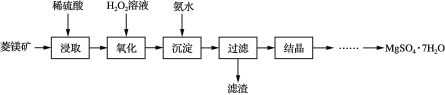
(1)“浸取”时通常将菱镁矿石进行粉碎,其目的是___。
(2)写出碳酸镁与稀硫酸反应的化学方程式___。
(3)“氧化”和“沉淀”是将“浸取”过程中产生的Fe2+转化为Fe(OH)3沉淀,则“过滤”所得滤液中含有的阳离子主要有___和___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学的核心是发生化学反应,利用化学反应合成物质,同时也伴随有能量的变化,下列有关说法中不正确的是( )
A.只要发生化学反应就一定有能量变化
B.Zn+2HCl=ZnCl2+H2↑这是一个放热反应,结论:1molZn和2molHCl的能量之和高于1molZnCl2和1molH2的能量之和
C.反应A+B=C+D的能量变化如图所示,反应物A和B断裂化学键吸收总能量低于形成生成物C和D释放的总能量

D.发生化学反应实现了化学能和其他形式能量之间的相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究水体中碘的存在形态及其转化是近年的科研热点。I-与I2在水体和大气中的部分转化如下图所示。
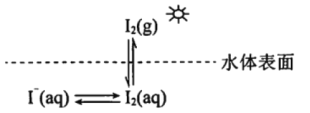
(1) I2的电子式为______________。
(2)水体中的I-在非酸性条件下难于被空气中的![]() 氧化。原因是
氧化。原因是![]() 的反应速率慢,反应程度小。
的反应速率慢,反应程度小。
①I-在酸性条件下与![]() 反应的离子方程式是_____________________________________。
反应的离子方程式是_____________________________________。
②在酸性条件下I-易被![]() 氧化的可能的原因是______________________________________。
氧化的可能的原因是______________________________________。
(3)有资料显示:水体中若含有![]() ,会对
,会对![]() 氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的
氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的![]() 通入到
通入到![]() 下列试剂中,一段时间后,记录实验现象与结果。己知:每
下列试剂中,一段时间后,记录实验现象与结果。己知:每![]() 参与反应,生成
参与反应,生成![]() 。
。
序号 | 试剂组成 | 反应前溶液的 | 反应后溶液的 |
|
|
甲 |
| 5.3 | 11.0 | 约10% | |
乙 |
| 5.1 | 4.1 | 约100% | 大量 |
丙 |
| 5.2 | 3.5 | —— | 少量 |
①![]() _______________________。
_______________________。
②甲中反应为可逆反应,其离子方程式是________________________。
③比较甲、乙、丙实验,说明![]() 在实验乙中的作用并解释_______________________。
在实验乙中的作用并解释_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com