
【题目】铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于_________区。
(2)Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ ,请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别:_________。Mn2+的半径_________ Fe3+的半径(填“>”、“<”或“=”)。
(3)金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为_________(用含π的式子表示)。
(4)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。N、H、O三种元素的电负性由大到小的顺序为_________;[Fe(SCN)(H2O)5]2+中Fe3+的配位数为_________,H2O中氧原子的杂化方式为_________。
(5)二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2,可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H![]() )配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π
)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H![]() 的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
A 离子键 B 配位键 C σ 键 D 范德华力
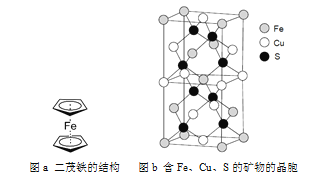
(6)一种含有Fe、Cu、S三种元素的矿物的晶胞(如上图b所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为A pm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________ g/cm3(写出表达式)。
【答案】d Mn2+为3d5构型,d亚层半满,失去电子则需破坏此稳定结构,Fe2+为3d6,易失去1个电子成为稳定的3d5构型 > ![]() O>N>H 6 sp3
O>N>H 6 sp3 ![]() A FeCuS2(或CuFeS2)
A FeCuS2(或CuFeS2) ![]() (或
(或![]() )
)
【解析】
(1)铁元素位于元素周期表VIII族,属于d区元素;
(2)Mn2+为3d5构型,d亚层半满,失去电子则需破坏此稳定结构,Fe2+为3d6,易失去1个电子成为稳定的3d5构型,因此Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+;Mn2+与Fe3+核外电子数相同,质子数多的半径小,故半径Mn2+>Fe3+;
(3)设晶胞中铁原子半径为r,则晶胞边长为a=![]() ,则1个体心立方堆积的晶胞体积为
,则1个体心立方堆积的晶胞体积为![]() ,晶胞内共有
,晶胞内共有![]() 个原子,原子总体积为:
个原子,原子总体积为:![]() ,则其空间利用率为:
,则其空间利用率为: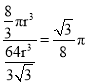 ;
;
(4)N、O处于同一周期,从左至右电负性逐渐增加,H元素在非金属元素中电负性最小,故电负性大小关系为:O>N>H;SCN-、H2O均为配体,因此[Fe(SCN)(H2O)5]2+中Fe3+的配位数为6;H2O中O的价层电子对数为![]() ,故氧原子的杂化方式为sp3;
,故氧原子的杂化方式为sp3;
(5)由![]() 结构可知,每个碳原子中还有1个电子未参与成键,5个碳原子以及一个
结构可知,每个碳原子中还有1个电子未参与成键,5个碳原子以及一个![]() 得到一个电子,共有6个电子参与形成大π键,因此
得到一个电子,共有6个电子参与形成大π键,因此![]() 中大π键表示为
中大π键表示为![]() ;由二茂铁的熔点低以及易升华特点可知二茂铁为分子化合物,因此二茂铁晶体中不存在离子键;
;由二茂铁的熔点低以及易升华特点可知二茂铁为分子化合物,因此二茂铁晶体中不存在离子键;
(6)根据均摊法可知,1个晶胞中含Cu原子数为:![]() ,Fe原子数为:
,Fe原子数为:![]() ,S原子数为:8,故此矿物的化学式为:FeCuS2(或CuFeS2);晶胞密度
,S原子数为:8,故此矿物的化学式为:FeCuS2(或CuFeS2);晶胞密度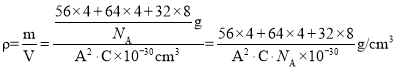 或
或![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高分子聚合物P的合成路线如图:

(1)写出反应所需试剂与条件。反应①___;反应⑦___。
(2)写出反应类型:反应③___;反应⑥___。
(3)写出结构简式.E___;P___。
(4)设计反应⑥⑦的目的是___。
(5)写出用1,3-丁二烯与乙酸为原料合成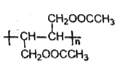 的合成路线(无机原料任选)___。
的合成路线(无机原料任选)___。
(合成路线的常用表示方法为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以0.10mol/L的氢氧化钠溶液滴定同浓度某一元酸HA的滴定曲线如图所示(![]() )。下列表述错误的是( )
)。下列表述错误的是( )
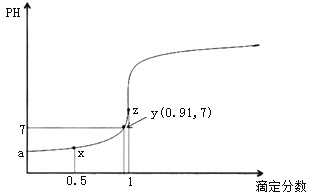
A.z点后存在某点,溶液中的水的电离程度和y点的相同
B.a约为3.5
C.z点处,![]()
D.x点处的溶液中离子满足:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶解度也可用物质的量浓度表示,25℃时,Ag2CrO4在不同浓度CrO42-溶液中的溶解度如图所示。又知Ksp(AgCl)=1.8×10-10。下列说法正确的是
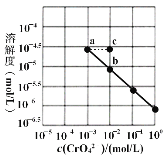
A.图中a、b两点c(Ag+)相同
B.该温度下,Ag2CrO4溶度积的数量级为10-12
C.加热蒸发饱和Ag2CrO4溶液再恢复到25℃,可使溶液由a点变到b点
D.将0.01 mol/L AgNO3溶液滴入20mL0.01 mol/L KCl和0.01 mol/L K2CrO4的混合溶液中,CrO42-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是
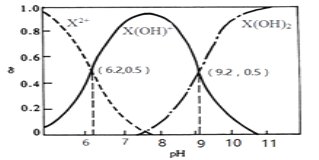
A.Kb2的数量级为10-8
B.X(OH)NO3水溶液显酸性
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中 c(X2+)>c[X(OH)+]
D.在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VCB是锂离子电池的一-种添加剂,以环氧乙烷(EO)为原料制备VCB的一种合成路线如下:
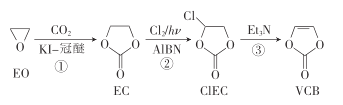
下列说法错误的是
A.反应①的原子利用率为100%
B.②的反应类型为取代反应.
C.EO、EC的一氯代物种数相同
D.CIEC、VCB分子中所有原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生反应生成中间体Fe。下列说法不正确的是
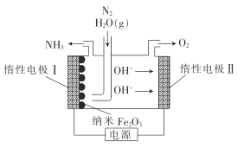
A.惰性电极II是电解池的阳极,发生氧化反应
B.生成氨气的反应:2Fe+N2+3H2O=Fe2O3+2NH3
C.惰性电极I的电极反应:Fe2O3+3H2O+6e -=2Fe+ 6OH-
D.产生2.24LO2时,转移的电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,运用电离理论做出的预测正确的是
A.测定某二元弱酸钠盐溶液的pH,可能小于7
B.稀释0.1mol/LCH3COOH(aq),![]() 可能变大也可能变小
可能变大也可能变小
C.在20.00mL浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液至pH=7,NaOH溶液体积一定小于20.00mL
D.pH=8的碱性溶液中一定没有CH3COOH分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合草酸亚铁(FeC2O4·xH2O)在制药工业上有广泛应用。以莫尔盐[(NH4)2SO4·FeSO4·6H2O]为原料制备FeC2O4·xH2O,并探究其性质。回答下列问题:
已知:草酸亚铁晶体为淡黄色粉末,难溶于水,溶于稀酸;pH>4时,Fe2+容易被氧化。
I.制备FeC2O4·xH2O(如图)
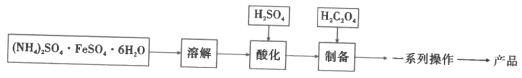
(1)加入H2SO4的目的是__。
(2)制备步骤的离子方程式是__。
(3)一系列操作是__。
II.探究FeC2O4·xH2O的分解产物:CO2、CO(如图)
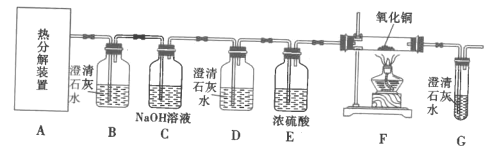
(4)装置D的作用是__,证明分解产物中存在CO的现象是__。
(5)从绿色化学角度考虑,实验存在不足之处,指出并提出解决方案:__。
III.定量测定FeC2O4·xH2O的化学式[M(FeC2O4)=144]
操作步骤:准确称取mg草酸亚铁晶体,溶于V1mL、c1mol·L-1的H2SO4溶液中,加热,用KMnO4标准溶液滴定至终点,加入锌粉将Fe3+恰好全部还原为Fe2+,然后用c2mol·L-1KMnO4标准溶液滴定至终点,记录消耗KMnO4标准溶液的体积为V2mL。
(6)第二次使用KMnO4标准溶液滴定的离子方程式为__。
(7)x=_(用字母表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com