
【题目】甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质。下表所列各组物质之间通过一步反应不能实现如图所示转化的是( )
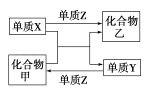
选项 | X | Y | Z | 甲 | 乙 |
A | C | H2 | O2 | H2O | CO |
B | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
C | Mg | C | O2 | CO2 | MgO |
D | H2 | Si | Cl2 | SiCl4 | HCl |
A.AB.BC.CD.D
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要含Al2O3、SiO2,还有少量的Fe2O3)为原料制取Al2O3的流程如下:
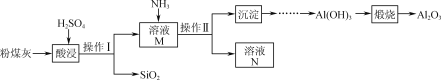
(1)操作Ⅰ的名称是________;溶液N中的溶质主要是____________(填化学式)。
(2)用H2SO4“酸浸”时的离子方程式为__________________________________(任写一个)。
(3)“煅烧”时的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基态原子由原子核和绕核运动的电子组成,下列有关核外电子说法正确的是
A.基态原子的核外电子填充的能层数与元素所在的周期数相等
B.基态原子的核外电子填充的轨道总数一定大于或等于![]() (m表示原子核外电子数)
(m表示原子核外电子数)
C.基态原子的核外电子填充的能级总数为![]() (n为原子的电子层数)
(n为原子的电子层数)
D.基态原子的核外电子运动都有顺时针和逆时针两种自旋状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能得出相应结论的是( )
实验 | 现象 | 结论 | |
A | 向浓度均为 |
| 非金属性: |
B. | 向含有酚酞的 | 观察到红色变浅 | 证明 |
C | 室温下,用pH试纸测 |
|
|
D. | 向盛有10滴 | 有黄色沉淀生成 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列物质的转化关系,回答问题:
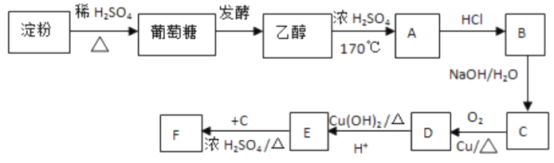
(I)淀粉属于___。
A.多糖 B.酯类 C.高分子化合物 D.单糖
(2)葡萄糖常用于水壶胆镀银,说明它有___(写出官能团名称);
(3)完成下列方程式:C6H12O6![]() 2C2H5OH+2___
2C2H5OH+2___
(4)写出B的结构简式:___;
(5)写出下列化学方程式:
①C→D:___;
②E+C→F:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究水体中碘的存在形态及其转化是近年的科研热点。I-与I2在水体和大气中的部分转化如下图所示。
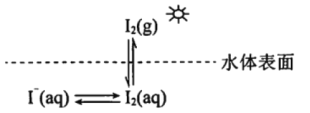
(1) I2的电子式为______________。
(2)水体中的I-在非酸性条件下难于被空气中的![]() 氧化。原因是
氧化。原因是![]() 的反应速率慢,反应程度小。
的反应速率慢,反应程度小。
①I-在酸性条件下与![]() 反应的离子方程式是_____________________________________。
反应的离子方程式是_____________________________________。
②在酸性条件下I-易被![]() 氧化的可能的原因是______________________________________。
氧化的可能的原因是______________________________________。
(3)有资料显示:水体中若含有![]() ,会对
,会对![]() 氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的
氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的![]() 通入到
通入到![]() 下列试剂中,一段时间后,记录实验现象与结果。己知:每
下列试剂中,一段时间后,记录实验现象与结果。己知:每![]() 参与反应,生成
参与反应,生成![]() 。
。
序号 | 试剂组成 | 反应前溶液的 | 反应后溶液的 |
|
|
甲 |
| 5.3 | 11.0 | 约10% | |
乙 |
| 5.1 | 4.1 | 约100% | 大量 |
丙 |
| 5.2 | 3.5 | —— | 少量 |
①![]() _______________________。
_______________________。
②甲中反应为可逆反应,其离子方程式是________________________。
③比较甲、乙、丙实验,说明![]() 在实验乙中的作用并解释_______________________。
在实验乙中的作用并解释_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇和乙酸是生活中两种常见的有机物。请回答下列问题:
(1)乙醇的结构简式为CH3CH2OH,乙醇的官能团名称为__________;乙酸的结构简式为CH3COOH,乙酸的官能团名称为__________;生活中常用食醋除去暖瓶内的水垢(主要成分是CaCO3),反应的化学方程式为2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O。通过这个事实,你得出醋酸与碳酸的酸性强弱关系是:醋酸_____碳酸(填“>”或“<”);
(2)在浓硫酸的催化作用下,加热乙酸和乙醇的混合溶液,可发生酯化反应。请完成化学方程式:CH3COOH + CH3CH2OH CH3COOCH2CH3+________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
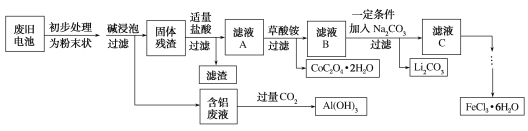
已知:①还原性:Cl->Co2+;
②Fe3+和![]() 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________。
(2)从含铝废液得到Al(OH)3的离子方程式为___________
(3)滤液A中的溶质除HCl、LiCl外还有________(填化学式)。写出LiCoO2和盐酸反应的化学方程式____________
(4)滤渣的主要成分为_______(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120~220 | CoC2O4·2H2O CoC2O4+2H2O | 19.67% |
Ⅱ | 300~350 | ______ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02 mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是石油化学工业的重要基础原料,我国科学家利用甲醇转化制丙烯反应过程如下:
3CH3OH +H3AlO6 →3![]() +
+![]() +3H2O
+3H2O
3![]() +
+![]() →H3AlO6 + 3C○↑↓H2
→H3AlO6 + 3C○↑↓H2
3C○↑↓H2 → CH2=CHCH3
下列叙述错误的是
A.甲醇转化制丙烯反应的方程式为3CH3OH→CH2=CHCH3+3H2O
B.甲醇转化制丙烯反应的过程中H3AlO6作催化剂
C.1.4 g C○↑↓H2所含的电子的物质的量为1 mol
D.甲基碳正离子![]() 的电子式为
的电子式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com